Tweede Kamer der Staten-Generaal
|
|
|
- Victor van de Veen
- 5 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Tweede Kamer der Staten-Generaal 2 Vergaderjaar Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste voorvallen Nr. 6 NOTA NAAR AANLEIDING VAN HET VERSLAG Ontvangen 18 februari 2014 Met belangstelling heb ik kennis genomen van de vragen en opmerkingen van de leden van de vaste Commissie voor Volksgezondheid, Welzijn en Sport. Ik dank de leden van de commissie voor hun inbreng en spreek de hoop uit dat het wetsvoorstel met deze beantwoording van de gestelde vragen op korte termijn kan worden geagendeerd voor plenaire behandeling. Hieronder ga ik graag in op de vragen en opmerkingen van de leden van de verschillende fracties. Ik ga daarbij uit van de volgorde van de vragen in het verslag, waarbij in een aantal gevallen naar antwoorden op samenhangende vragen wordt verwezen. 1. Aanleiding De leden van de CDA-fractie vragen hoe er tussen de toezending van een brief over de aanpassing van de wet in 2010 en de bekrachtiging van het onderhavige wetsvoorstel door beide kamers in de praktijk wordt omgegaan met het geconstateerde probleem, namelijk de onduidelijkheid over het meldingsregime, en vragen op dit punt om een uitgebreide toelichting. Het wetsvoorstel ziet op het verduidelijken van het meldingsregime voor niet-geneesmiddelenonderzoek. Met de implementatie van de Europese richtlijn voor goede klinische praktijk (2001/20/EG) 1 zijn voor geneesmiddelenonderzoek al meer specifieke regels gesteld in paragraaf 5a van de Wet medisch-wetenschappelijk onderzoek met mensen (verder: de WMO). Verrichters en uitvoerders van geneesmiddelenonderzoek hebben dan ook al ruime ervaring met deze meldingsplicht. Dit betreft vrijwel uitsluitend commerciële verrichters en de daarvoor werkzame uitvoerders. Om de registratie en meldingen van ernstige ongewenste voorvallen bij niet-geneesmiddelenonderzoek te verduidelijken in afwachting van de wijziging van de wet, heeft de Centrale commissie mensgebonden 1 Richtlijn 2001/20/EG van het Europees parlement en de Raad van 4 april 2001 betreffende de onderlinge aanpassing van de wettelijke en bestuursrechtelijke bepalingen van de lidstaten inzake de toepassing van goede klinische praktijken bij de uitvoering van klinische proeven met geneesmiddelen voor menselijk gebruik (PbEG L 121) kst ISSN s-gravenhage 2014 Tweede Kamer, vergaderjaar , , nr. 6 1
2 onderzoek (CCMO) vanaf 1 januari 2010 aangegeven dat niet-commerciële verrichters elektronisch melding moeten maken van alle ernstige ongewenste voorvallen en bijwerkingen die zich voordoen. In aanvulling daarop is gewerkt aan een bewustwording van het belang van de meldingen, en bekendheid van de nieuwe werkwijze bij onderzoekers in trainingen. Sinds enige jaren zijn klinisch onderzoekers uit de Universitaire Medische Centra door de centra zelf verplicht de Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers (BROK-cursus) te volgen. Ook onderzoekers in de ziekenhuizen die deel uitmaken van de Samenwerking Topklinische opleidingsziekenhuizen (STZ) kunnen inmiddels van deze cursus gebruik maken. Daarin wordt specifiek aandacht besteed aan de meldingsprocedure. De CCMO heeft daarnaast een gratis toegankelijke e-learning module «Onderzoekwijs» gemaakt waarin onderzoekers wordt uitgelegd wat de procedure is voor het melden van ernstig ongewenste voorvallen en bijwerkingen. Tevens heeft de CCMO in haar model onderzoeksprotocol een sectie opgenomen waarin de procedure voor het melden van ernstig ongewenste voorvallen en bijwerkingen is beschreven. Dit dient als hulpmiddel voor onderzoekers die een onderzoeksprotocol bij de erkende medisch-ethische toetsingscommissie (METC) indienen. Door deze maatregelen zijn verrichters en uitvoerders ook bij niet-geneesmiddelenonderzoek bekend met het registeren en melden van ernstige ongewenste voorvallen en bijwerkingen. Dit laat overigens onverlet dat een wettelijke verankering van de meldingsplicht, en het vastleggen voor welke voorvallen deze plicht geldt, noodzakelijk is. 2. Algemene meldingsplicht ernstige ongewenste voorvallen De leden van de VVD-fractie vragen om een nadere duiding van ernstige ongewenste voorvallen die vooraf te voorzien zijn, die omschreven staan in het onderzoeksprotocol en die dus niet onmiddellijk door de onderzoeker gerapporteerd hoeven te worden. Bij ernstige ongewenste voorvallen die vooraf te voorzien zijn, kan bijvoorbeeld gedacht worden aan nieuwe therapieën die tegen kanker worden ingezet en waarvan algemeen bekend is dat deze ernstige ongewenste neveneffecten kunnen hebben. Dit geldt voor nieuwe cytostatica, maar bijvoorbeeld ook chirurgische ingrepen kunnen met aanzienlijk risico s gepaard gaan. Bij bestaande technieken gericht op het verwijderen van de prostaat zijn impotentie en incontinentie bekende risico s. Het onderzoeken van een nieuwe techniek levert mogelijk een effectievere behandeling op met een verlaagd risico ten opzichte van bestaande behandelmogelijkheden. Toch kunnen ernstige ongewenste voorvallen daarbij niet altijd geheel worden uitgesloten. Daarnaast vragen deze leden waarom het voorstel voorziet in een uitzonderingsmogelijkheid en hoe zal worden voorkomen dat niet alle ernstige ongewenste voorvallen op voorhand in het onderzoeksprotocol worden opgenomen. Ook wensen zij te vernemen hoe zal worden voorkomen dat verschillende METC s op verschillende wijze op dit punt toetsen. De uitzonderingsmogelijkheid om niet alle ernstige ongewenste voorvallen direct te melden, hangt samen met het gegeven dat in sommige gevallen deze voorvallen zijn te voorzien, zoals hierboven aangegeven. Het onverkort laten gelden van een meldingsplicht bij onderzoek waarbij ernstige neveneffecten kunnen worden verwacht, zou het beoogde effect van de meldingsplicht verstoren. De betrokken METC s zouden een grote hoeveelheid meldingen ontvangen die weliswaar ernstige ongewenste voorvallen betreffen, maar deels ook waren te Tweede Kamer, vergaderjaar , , nr. 6 2
3 voorzien. Dit zou een onnodig grote toetsingslast voor de METC s opleveren. METCs kunnen bij de toetsing verplichten dat in het protocol overzichtslijsten worden voorgeschreven, zogenaamde «line listings», van ernstige voorvallen die periodiek dienen te worden ingezonden. Daarnaast wordt in het protocol van risicovolle onderzoeken regelmatig aan de onderzoekers de verplichting opgelegd een Data Safety Monitoring Committee (DSMC) in te stellen, die onafhankelijk van de onderzoekers de veiligheid van de trial volgt. Deze DSMC kan ook een analyse doen van ongeblindeerde trial gegevens, indien er sprake is van een geblindeerd onderzoek. Bij geblindeerd onderzoek weet de onderzoeker zelf niet welke proefpersonen een nieuwe therapie krijgen en welke een placebo om ongewenste beïnvloeding van de resultaten te voorkomen. Voor de beoordeling van de ernstige ongewenste voorvallen is het belangrijk om te weten of deze met de studie-interventie samenhangen. De procedure van de DSMC wordt in een speciaal daartoe op te stellen reglement vastgelegd, ook wel het «Charter» genoemd. Dit Charter is onderdeel van het toetsingproces. Bij de beoordeling ervan gaat het er met name om of er tijdig die situaties mee kunnen worden opgespoord waarbij het stilleggen van het onderzoek ten behoeve van de veiligheid van de proefpersonen aan de orde is. De indiener van het onderzoeksprotocol zal, alvorens het onderzoek van start gaat, een positief oordeel moeten krijgen van de toetsingscommissie. Op grond van de voorgestelde wijziging van artikel 2, derde lid, van de WMO, zal de toetsingscomissie bij de beoordeling van het onderzoeksprotocol nagaan of de afwijking van het algemene meldingsregime kan worden gerechtvaardigd. Indien dit onvoldoende gemotiveerd is, zal er geen positief oordeel worden verkregen en kan het onderzoek dus niet aanvangen. Om de procedures verder te uniformeren hebben CCMO en de Nederlandse vereniging van medisch-ethische toetsingscommissies (NVMETC) besloten samen een toetsingskader op te stellen voor de wijze waarop erkende METC s en de CCMO de procedures voor het melden van ernstige ongewenste voorvallen en bijwerkingen, zoals vastgelegd in het onderzoeksprotocol, gaan beoordelen. Dit zal bijdragen aan de harmonisatie in werkwijze tussen de verschillende METC s. De leden van deze fractie vragen voorts hoe het overlijden van een proefpersoon ooit in een onderzoeksprotocol kan worden aangeduid als een vooraf te voorzien ernstig ongewenst voorval. Bovendien wensen zij antwoord op de vraag in hoeverre een onderzoeksprotocol kan worden goedgekeurd wanneer sprake is van vooraf te voorziene ernstige ongewenste voorvallen. Gedacht kan worden aan therapieën die als laatste redmiddel worden ingezet bij zeer ernstig zieke patiënten om deze een kans te geven op genezing en dus hun leven te redden, of wellicht althans hun leven te verlengen. Dergelijke therapieën kunnen hele ernstige neveneffecten hebben, en ondanks dat een deel van patiënten er juist langer door kan leven of misschien zelfs geneest, zal het in sommige gevallen het eerder overlijden van een enkele al zeer ernstig of terminaal zieke patiënt betekenen. In het onderzoeksprotocol wordt aangegeven in welke mate met dergelijke ernstige ongewenste effecten rekening wordt gehouden. Bij de goedkeuring door een METC zal worden bezien of dergelijke effecten in een redelijke verhouding staan tot de standaardbehandeling, de verwachte voordelen van het onderzoek, en wanneer melding daarvan geboden is. Ook vragen deze leden of het mogelijk is dat een onderzoeksprotocol wordt goedgekeurd waarin staat aangegeven dat bepaalde ernstige ongewenste voorvallen geheel niet gemeld worden. Tweede Kamer, vergaderjaar , , nr. 6 3
4 De uitzondering in het voorgestelde artikel 10, eerste lid, van de WMO, betreft de onmiddellijke melding van de uitvoerder aan de verrichter. In het protocol kan wel worden bepaald dat een onmiddellijke melding niet noodzakelijk is, maar de verrichter zal dan op een in het protocol aangegeven tijdstip wel moeten worden geïnformeerd. Het is immers de verrichter die op basis van alle verzamelde gegevens kan beoordelen of melding aan een toetsingscommissie aan de orde is. Deze in artikel 10, tweede lid, opgenomen meldingsplicht kan achterwege blijven als daaruit geen meerwaarde in de bescherming van proefpersonen voortvloeit. Goedkeuring vooraf door de toetsingscommissie vormt een waarborg dat zeer terughoudend met deze mogelijkheid zal worden omgegaan, en er alleen van melding wordt afgezien als dat geen toegevoegde waarde heeft. Wanneer daarover geen zekerheid kan worden gegeven, zal melding onverkort moeten plaatsvinden, en kan hoogstens bezien worden binnen welke termijnen de meldingen dienen plaats te vinden. Verder vragen de leden van deze fractie of de METC die het onderzoeksprotocol in eerste instantie heeft goedgekeurd, ook de instantie is die beoordeelt of een onderzoek na een melding van een ernstig ongewenst voorval al dan niet doorgang kan vinden. De meldingsplicht geldt inderdaad ten aanzien van de commissie die het onderzoeksvoorstel heeft beoordeeld. Deze commissie heeft uitvoerig kennis kunnen nemen van de opzet van het onderzoek, en kan daarmee goed in staat worden geacht te bezien wat de waarde van eventuele meldingen is, en welke consequenties daaraan moeten worden verbonden. Deze commissie kan ook, op basis van artikel 3a, eerste lid, van de WMO, een eerder gegeven positief oordeel opschorten of intrekken indien er gegronde redenen zijn om aan te nemen dat voortzetting van het wetenschappelijk onderzoek zou leiden tot onaanvaardbare risico s voor de proefpersoon. De leden van de PvdA-fractie vragen waarom ervoor wordt gekozen dat de onderzoeker alleen meldt aan de verrichter (opdrachtgever). In dat verband vragen zij tevens in welke concrete situaties er in ieder geval sprake zal zijn van ernstige ongewenste voorvallen opdat voortzetting van het onderzoek tot onaanvaardbare risico s voor de proefpersoon leidt. De reden dat de onderzoeker meldt aan de verrichter heeft met een duidelijke verdeling van verantwoordelijkheden te maken. Uitvoerders melden alle ernstige ongewenste voorvallen aan de verrichter. De verrichter dient vervolgens, waar nodig, zorg te dragen voor meldingen aan de toetsingscommissie. Het is immers de verrichter die, in tegenstelling tot afzonderlijke uitvoerders van het onderzoek, overzicht heeft over alle ernstige ongewenste voorvallen die zich op de verschillende locaties van het onderzoek hebben voorgedaan, nu deze verplicht door de uitvoerders moeten worden gemeld. Van concrete situaties waarin voorzetting van het onderzoek tot onaanvaardbare risico s leidt, is in elk geval sprake als het ernstige vermoeden bestaat dat sprake is van onvoorziene ernstige gevolgen voor de proefpersoon. Gedacht kan worden aan een hogere dan verwachte sterfte in de onderzoekspopulatie, maar ook aan onverwachte blijvende schade of neveneffecten die niet in redelijke verhouding staan tot de verwachte risico s en bezwaren van het onderzoek. Het zal afhangen van de omstandigheden van het geval; de aard van het onderzoek bepaalt welke risico s verwacht kunnen worden. Bij een onderzoek naar nieuwe therapieën om kanker te bestrijden is schade aan de proefpersoon niet uit te sluiten, en hoeft dus niet steeds een meldingsplichtig ernstig ongewenst voorval op te leveren. Wel kan zich schade voordoen in een Tweede Kamer, vergaderjaar , , nr. 6 4
5 veel ernstiger mate of op een andere wijze dan voorzien. In die situatie zal moeten worden bezien of sprake is van onaanvaardbare risico s voor de proefpersonen die aan voortzetting van het onderzoek in de weg staan. Bij onderzoek naar een nieuwe therapie om bijvoorbeeld misselijkheid tegen te gaan, zal in het geheel geen schade verwacht mogen worden, en zal een indicatie van blijvende schade direct aanleiding vormen om van onaanvaardbare risico s te spreken. Deze leden hebben voorts gezien dat de Data and Safety Monitoring Committee (DSMC) aan de verrichter kan adviseren om de studie op te schorten, dan wel voortijdig te beëindigen en vragen in hoeverre dit advies dwingend van aard is en zo ja, wat de consequenties zijn van het niet opvolgen van een advies van de DSMC. Wanneer een DSMC door de verrichter wordt ingesteld, worden criteria om de studie voortijdig te staken in het daartoe op te stellen reglement, het «Charter» opgenomen. In dit Charter wordt daarnaast de samenstelling en werkwijze geregeld. Bij het opstellen van de DSMC kan worden bepaald of de DSMC adviserend of uitvoerend te werk gaat, en daarmee ook welke gevolgen daaraan zijn verbonden. Een DSMC kan worden ingezet om de voortgang, veiligheid en betrouwbaarheid van een studie te volgen en daarbij gebruik te maken van interim analyses. Als in het Charter voor de DSMC een adviserende rol is opgenomen, zal de verrichter die wil afwijken van een gegeven advies dat moeten kunnen verantwoorden: de motivering moet het besluit tot afwijking kunnen dragen. Tevens geldt dan de verplichting om de METC over het niet opvolgen van het advies van de DSMC te informeren. Daarnaast wensen de leden van deze fractie te vernemen of er een meldingsplicht bestaat in het geval van internationale multicenter studies voor niet-geneesmiddelenonderzoek, of dat dat alleen het geval is bij geneesmiddelenonderzoek. Op dit moment geldt internationaal een verplichting voor geneesmiddelenonderzoek op basis van de richtlijn voor klinische proeven in Europa (2001/20/EG) en de daaraan ten grondslag liggende algemene beginselen van goed geneesmiddelenonderzoek, zoals onder meer vastgelegd in de Verklaring van Helsinki en het richtsnoer voor Good Clinical Practice. Voor klinisch onderzoek met medische hulpmiddelen zoals bedoeld in het artikel 13 van het Besluit medische hulpmiddelen geldt een meldingsplicht richting de bevoegde instanties. In Nederland is dit de Inspectie voor de Gezondheidszorg. De leden van de fractie van de SP vragen waarom er is gekozen voor een mogelijkheid om af te wijken van de meldingsplicht en verzoeken om een nadere onderbouwing. Ook vragen zij om concrete voorbeelden van gevallen waarin melden niet gewenst is en waarom. Voor de beantwoording van deze vragen kan worden verwezen naar de reactie op vergelijkbare vragen van de VVD-fractie hierboven. Voorts missen de leden van de fractie van de SP een onderbouwing waarom er is gekozen voor een melding van een overlijden binnen zeven dagen en andere voorvallen binnen vijftien dagen. Op basis van welke argumenten is gekozen voor deze termijnen? Beide termijnen vloeien voort uit de huidige richtlijn voor klinische proeven (2001/20/EG), zoals die in de artikelen 13o, 13p en 13q van de WMO is geïmplementeerd. Daarin is bepaald dat ernstige bijwerkingen die tot de dood van een proefpersoon hebben geleid of kunnen leiden zo Tweede Kamer, vergaderjaar , , nr. 6 5
6 spoedig mogelijk, doch uiterlijk binnen zeven dagen nadat daarvan kennis is genomen, worden gemeld. Andere onverwachte ernstige bijwerkingen moeten uiterlijk binnen vijftien dagen worden gerapporteerd. Er is in dit wetsvoorstel voor gekozen deze termijnen aan te houden, zodat er eenzelfde meldingsregime met termijnen geldt voor zowel geneesmiddelenonderzoek als ander onderzoek dat onder de reikwijdte van de wet valt. Ook vragen zij waarom niet gekozen is voor een onmiddellijke rapportage gevolgd door een gedetailleerd schriftelijk rapport, zoals daar bij de melding van de uitvoerder van het onderzoek aan diegene die het onderzoek verricht wel voor is gekozen. Zoals aangegeven is gekozen voor eenzelfde opzet als die nu geldt voor geneesmiddelenonderzoek op basis van de reeds genoemde Europese richtlijn. Daarbij is het van belang dat een uitvoerder van het onderzoek ieder ernstig ongewenst voorval in beginsel onverwijld meldt aan de verrichter. Deze kan vervolgens bezien of, gelet op eventuele voorvallen die zich hebben voorgedaan op andere locaties van het onderzoek, een zodanig verband met het onderzoek kan worden gelegd dat melding aan de toetsingscommissie geboden is. Het vereist enige bestudering van de gegevens van één of meerdere meldingen om tot een gewogen beslissing te komen over melding aan de toetsingscommissie, zodat onmiddellijke rapportage door de verrichter in veel gevallen niet mogelijk zal zijn. Daarnaast vragen de genoemde leden waarom hier is gekozen voor de mogelijkheid om van deze termijn af te wijken wanneer dit wordt gemotiveerd in het onderzoeksprotocol. Welke argumenten kunnen er zijn om af te wijken van deze meldingstermijn, zo vragen deze leden. Uitgangspunt is dat alle ernstige ongewenste voorvallen gemeld worden. Situaties waarop hier een uitzondering gemaakt kan worden zijn eerder beschreven. Deze behoeven dan geen onmiddellijke rapportage, maar zouden in periodieke overzichtsrapportages opgenomen kunnen worden, al naar gelang de aard van de studie. Ook het instellen van een DSMC die onder meer als taak heeft de veiligheid van de proefpersonen te monitoren kan ertoe leiden dat afgezien kan worden van de wettelijke meldingstermijn. De CCMO en de Nederlandse vereniging van medischethische toetsingscommissies (NVMETC) zullen samen een toetsingskader opstellen voor het beoordelen van de meldingsprocedure waarin aangegeven zal worden onder welke omstandigheden afwijking van de meldingstermijn gerechtvaardigd kan zijn. De leden van de CDA-fractie kunnen zich voorstellen dat het niet direct melden van het overlijden van een proefpersoon onder «ernstige ongewenste voorvallen» valt en vragen de regering om aan te geven wat er haar inziens nog meer onder deze term valt. Kan de regering hiervan voorbeelden geven, zo vragen deze leden. Ernstig ongewenste voorvallen zijn gedefinieerd in de EU-richtlijn 2001/20/EG en als zodanig opgenomen in de definities van de WMO. Het betreft alle voorvallen die dodelijk zijn, levensgevaar opleveren voor de proefpersoon, opname in een ziekenhuis of verlenging van de opname noodzakelijk maken, blijvende of significante invaliditeit of arbeidsongeschiktheid veroorzaken dan wel zich uiten in een aangeboren afwijking of misvorming. Bovendien wensen de leden van de genoemde fractie te vernemen hoe deze wijziging de WMO zich verhoudt tot voorstel voor een verordening betreffende klinische proeven met geneesmiddelen voor menselijk gebruik en tot intrekking van Richtlijn 2001/20/EG. Tweede Kamer, vergaderjaar , , nr. 6 6
7 Het voorliggende wijzigingsvoorstel zorgt ervoor dat de huidige meldingsplicht voor geneesmiddelenonderzoek ook voor ander onderzoek gaat gelden, maar laat de huidige regels voor geneesmiddelenonderzoek onverlet. Op dit moment wordt door de Europese Raad met het Europese Parlement en de Commissie onderhandeld over eventuele aanpassing van de regels voor geneesmiddelenonderzoek. Het is nog onduidelijk of er nieuwe regels voor het melden van bijwerkingen komen, en als dat zo is ook hoe deze een meldingsplicht bij geneesmiddelenonderzoek zullen beïnvloeden. Dat zal pas kunnen worden bezien als de verordening is vastgesteld door het Europees Parlement en de Raad. In reactie op de bevinding van het onderzoeksrapport naar de PROPATRIAstudie dat «voor niet-geneesmiddelenonderzoek de melding van ernstige ongewenste voorvallen niet duidelijk in de wet is verankerd», vragen de leden van de D66-fractie of dat betekent dat deze verplichting wel al is opgenomen in de huidige wet, alleen niet op een duidelijke wijze, of dat er tot op heden geen enkele verplichting tot melding bij niet-geneesmiddelen onderzoek bestaat. Er is thans wel een wettelijke meldingsplicht, deze staat in het huidige artikel 10 van de WMO. Het daarin opgenomen criterium, namelijk een «in noemenswaardige mate ongunstiger verloop voor de proefpersoon dan in het onderzoeksprotocol is voorzien», wordt in de praktijk onvoldoende duidelijk geacht. Ook bevat het artikel geen termijnen, en ligt de meldingsplicht bij de uitvoerder, waar deze vanuit de verdeling van verantwoordelijkheden in de wet beter bij de verrichter kan worden gelegd. Dit wetsvoorstel beoogt de onduidelijkheden weg te nemen met een duidelijke definitie van wat ernstige ongewenste voorvallen zijn, en het proces, de termijnen en verantwoordelijkheden te uniformeren voor zowel geneesmiddelenonderzoek als niet-geneesmiddelenonderzoek. 3. Reactie CCMO en toetsingscommissies Naar aanleiding van het signaal van de NVMETC dat er tussen de METC s op dit moment nog onwenselijke verschillen bestaan in de eisen die zij stellen aan het melden van ernstige ongewenste voorvallen, vragen de leden van de PvdA-fractie waaruit deze verschillen precies bestaan, op welke wijze deze ongewenste verschillen weggenomen zullen worden en binnen welke termijn. De verschillen waarop is gedoeld betreffen in het bijzonder de termijnen waarop METCs melding van een «in noemenswaardige mate ongunstiger verloop voor de proefpersoon dan in het onderzoeksprotocol is voorzien» willen ontvangen, en deels de uitleg van dit begrip. De verschillen zijn door een aantal initiatieven van de afgelopen jaren aanzienlijk verminderd. Zoals eerder genoemd heeft de CCMO sinds 2010 aangegeven dat ook niet-commerciële verrichters alle ernstige ongewenste voorvallen via de internetpagina ToetsingOnline aan de oordelende METC dienen te melden. In haar model onderzoeksprotocol heeft de CCMO een passage opgenomen over de meldingsprocedure. Verder hebben de METC s met de CCMO samen een model-besluit opgesteld waarin de meldingsvoorwaarden staan vermeld. Op deze wijze is uniformiteit tussen de verschillende METC s en de CCMO geborgd. Daarnaast zal als het huidige wetsvoorstel van kracht wordt door de CCMO en de NVMETC samengewerkt worden aan een handreiking voor de beoordeling van de meldingsprocedure, zoals opgenomen in het onderzoeksprotocol, met aandacht voor de uitzonderingsgrond. Tweede Kamer, vergaderjaar , , nr. 6 7
8 Daarnaast vragen deze leden wat de consequentie van het niet-melden van een ernstig ongewenst voorval door de uitvoerder van het onderzoek aan de verrichter van het onderzoek zal zijn en tevens van het niet-melden daarvan door de verrichter aan de oordelende toetsingscommissie. Het niet melden door de uitvoerder danwel verrichter wordt in dit wetsvoorstel opgenomen in artikel 33 van de WMO, en wordt daarmee strafbaar, zoals dat nu al voor geneesmiddelenonderzoek het geval is. Het ten onrechte niet melden door een uitvoerder of verrichter zal daarmee een overtreding opleveren die met een hechtenis van maximaal zes maanden of een geldboete van de vierde categorie kan worden bestraft. Eveneens naar aanleiding van het signaal van de NVMETC dat er tussen de METC s op dit moment nog onwenselijke verschillen bestaan in de eisen die zij stellen aan het melden van ernstige ongewenste voorvallen, vragen de leden van de D66-fractie of de regering op de hoogte is van de inhoud van deze meningsverschillen tussen de METC s en of deze met de Kamer kan worden gedeeld. Hierboven is reeds stilgestaan bij de onwenselijke verschillen in de eisen die METC s stellen bij de beantwoording van eenzelfde vraag van de PvdA-fractie, zodat daarnaar kan worden verwezen. 4. Gevolgen administratieve lasten en regeldruk De leden van de D66-fractie vragen naar aanleiding van de passage «De verplichting om ernstige ongewenst voorvallen te melden zal als gevolg van de voorgestelde wetswijziging, naast de al geldende meldingsplicht voor geneesmiddelenonderzoek, ook gaan gelden voor interventieonderzoek dat geen geneesmiddelenonderzoek is en voor observationeel onderzoek», om een toelichting van de keuze voor het in de wet opnemen van observationeel onderzoek. Bij observationeel onderzoek is er immers geen sprake van interventie, zo stellen zij. Het wetsvoorstel beoogt de meldingsplicht te laten gelden voor alle onderzoek dat onder de reikwijdte van de WMO valt, en niet alleen voor interventie-geneesmiddelenonderzoek, zoals bedoeld in de huidige paragraaf 5a. De reikwijdte van de WMO beslaat zowel geneesmiddelenals andere vormen van onderzoek waarbij proefpersonen aan handelingen worden onderworpen of hen een gedragswijze wordt opgelegd. Dit betekent dat zowel interventieonderzoek als observationeel onderzoek onder de wet kan vallen. In dat laatste geval is het risico veelal afhankelijk van hoe invasief de metingen zijn die worden verricht. Invasieve metingen kunnen zodanige risico s en/of belasting met zich meebrengen dat toetsing van het onderzoek daarbij geboden is. Het ligt dan voor de hand ook de meldingsplicht in die gevallen te laten gelden. Deze leden stellen voorts dat de wet is bedoeld om het melden van ernstige ongewenste voorvallen voor geneesmiddelenonderzoek en ander medisch-wetenschappelijk onderzoek, zoals onderzoek met voedingsmiddelen, medische hulpmiddelen, bestraling of chirurgisch ingrijpen, gelijk te trekken. Zij vragen hoe de verdeling is van de circa per jaar gestarte interventiestudies, niet zijnde geneesmiddelenstudies, en observationele studies. Van de gemiddeld per jaar beoordeelde studies, is iets meer dan de helft interventie- onderzoek. Ruim de helft daarvan is geneesmiddelenonderzoek waar de meldingsplicht nu al voor geldt. De overige interventies zijn met medische hulpmiddelen (16%), chirurgische ingrepen (7%), psychosociale interventies (6%), voeding(stoffen) (5%), radiotherapie (5%) Tweede Kamer, vergaderjaar , , nr. 6 8
9 of bewegingstherapie (3%). Deze cijfers worden elk jaar gepubliceerd in het jaarverslag van de CCMO. Bovendien vragen zij de regering toe te lichten waarop de verwachting is gebaseerd dat er gemiddeld 1 á 2 meldingen (per studie) gedaan zullen worden bij de genoemde studies per jaar. Deze schatting is gemaakt na overleg met de CCMO, en de gegevens die zij enige tijd hebben verzameld ten aanzien van dergelijke meldingen. Voor de schatting van het gemiddelde is gebruik gemaakt van het aantal meldingen die in de webportal ToetsingOnline zijn geregistreerd sinds de door de CCMO geïntroduceerde elektronische melding, en uitbreiding naar niet commerciële verrichters. 5. Artikelsgewijs Artikel 1 De leden van de VVD-fractie vragen naar aanleiding van de opsplitsing van het begrip «ernstig ongewenst voorval of ernstige bijwerking» in twee aparte termen, te weten «ernstig ongewenst voorval» en «ernstige bijwerking», hoe wordt omgegaan met al dan niet voorziene ernstige bijwerkingen of voorvallen. Waar staat dit omschreven, zo vragen zij bovendien. De meldingsplicht voor ernstige ongewenste voorvallen wordt ingevolge dit wetsvoorstel in artikel 10 geplaatst, en gaat daarmee voor alle vormen van onderzoek gelden, dus ook als het geen geneesmiddelenonderzoek is. De aan geneesmiddelen gerelateerde definitie voor bijwerkingen blijft dan gelden voor de artikelen 13p en 13q van de wet, als onderdeel van de paragraaf die specifiek over geneesmiddelenonderzoek gaat. Artikel 10 Naar aanleiding van het voorgestelde artikel 10, vierde lid, vragen de leden van de SP-fractie waarom in de memorie van toelichting wordt gesteld dat de verrichter het onderzoek «kan» opschorten of beëindigen. Moeten zij hier niet «moet» lezen, vragen deze leden. Wanneer dit niet het geval is vragen deze leden waarom hier niet de verplichting is opgenomen om de verrichtingen op te schorten of te staken. In veel gevallen zal een verrichter zelf al op basis van de gegevens die moeten worden doorgezonden aan de toetsingscommissie tot de conclusie komen dat het onderzoek tijdelijk of definitief moet worden gestaakt. Een melding van ernstige onverwachte voorvallen kan dus gepaard gaan met de mededeling van de verrichter dat deze het onderzoek reeds heeft stilgelegd, om met de toetsingscommissie te bezien of hervatting aan de orde kan zijn, en onder welke voorwaarden. Het opschorten of intrekken van het oordeel is dan onnodig. De bepaling reflecteert dat het primair een verantwoordelijkheid van de verrichter is om te bezien of opschorting van het onderzoek geboden is. Mocht deze niet van mening zijn dat (tijdelijke) stillegging aan de orde is waar de toetsingscommissie tot het oordeel is gekomen dat dit wel zou moeten gebeuren, dan kan zij haar bevoegdheid tot opschorten of intrekken van het oordeel inzetten. De leden van de CDA-fractie vragen in verband met de mogelijkheid om bepaalde ernstige ongewenste voorvallen uit te zonderen van de meldingsplicht van de uitvoerder en de verplichting om deze uitzondering in het onderzoeksprotocol aan te geven, of aan de uitvoerder/verrichter Tweede Kamer, vergaderjaar , , nr. 6 9
10 van het onderzoek wordt overgelaten gebruik te maken van het uitzonderingsprotocol of dat er een kader wordt afgesproken binnen de CCMO waarbinnen je gebruik kunt maken van het uitzonderprotocol. Welke ernstige ongewenste voorvallen niet gemeld hoeven te worden is met name afhankelijk van de aard van het onderzoek; de handelingen waaraan proefpersonen in dat kader worden onderworpen of de gedragswijze die wordt opgelegd en de daaraan verbonden verwachte risico s. Op basis van die specifieke kenmerken kan een afweging omtrent melding worden gemaakt bij het opstellen van het protocol. De CCMO zal samen met de NVMETC een toetsingskader opstellen, om daarin een nadere uitwerking te geven van de wijze waarop bij de toetsing beoordeeld wordt hoe gebruik gemaakt mag worden van deze uitzonderingsmogelijkheid in het protocol. Overigens kan de CCMO natuurlijk ook, indien nodig, haar bevoegdheid inzetten om richtlijnen op te stellen. De leden van de D66-fractie merken op dat in de huidige WMO in artikel 10 is vastgelegd dat degene die het onderzoek uitvoert ertoe verplicht is, indien het wetenschappelijk onderzoek een verloop neemt dat in noemenswaardige mate voor de proefpersoon ongunstiger is dan in het onderzoeksprotocol is voorzien, daarvan terstond mededeling te doen aan de proefpersoon, dan wel indien deze ingevolge deze wet niet bevoegd was tot het geven van toestemming, aan degene die daartoe in zijn plaats bevoegd was en aan de commissie die ingevolge artikel 2 van de WMO als laatste haar oordeel heeft gegeven, met een verzoek om een nader oordeel. Deze leden vragen waarom er in het nieuwe voorstel ervoor is gekozen degene die het onderzoek uitvoert onmiddellijk te laten rapporteren aan degene die het onderzoek verricht, maar niet direct (ook) de proefpersoon op de hoogte te stellen, zoals in het huidige artikel 10 het geval is. De plicht van de uitvoerder om de proefpersoon te informeren, zoals die in het huidige artikel 10 staat, wordt met deze wijziging ondergebracht in artikel 11. Op basis van het nieuwe artikel 11, eerste lid, onder b, rust op de uitvoerder, en niet de verrichter zoals abusievelijk in de memorie van toelichting is aangegeven de plicht de proefpersoon te informeren over het «verloop van het onderzoek». Dit omvat in ieder geval situaties waarin gegronde redenen bestaan om aan te nemen dat voortzetting van het onderzoek zal leiden tot onaanvaardbare risico s voor de proefpersoon, op basis waarvan de verrichter de uitvoering dient op te schorten, zoals aangegeven in het voorgesteld artikel 10, vierde lid. Om de bescherming van de proefpersoon te waarborgen en ervoor zorg te dragen dat hij goed op de hoogte blijft van eventuele ernstige, nadelige complicaties die zich tijdens het onderzoek voordoen, is ervoor gekozen uitdrukkelijk een verwijzing naar artikel 10, vierde lid, op te nemen bij de informatieplicht van de uitvoerder jegens de proefpersoon. Deze plicht geldt overigens ook ten opzichte van anderen die op basis van artikel 6 toestemming geven voor deelname aan het onderzoek, zo bepaalt het nieuwe artikel 11, derde lid. Bovendien vragen deze leden waarom er is gekozen voor termijnen van zeven en vijftien dagen voor de melding door de verrichter van het onderzoek aan de commissie die het onderzoeksprotocol heeft beoordeeld, terwijl degene die het onderzoek uitvoert onmiddellijk (gestreefd wordt naar binnen 24 uur) dient te rapporteren aan degene die het onderzoek verricht. De plicht om binnen de gestelde termijnen van zeven en vijftien dagen meldingen van ernstige ongewenste voorvallen te doen aan de toetsingscommissie komt bij de verrichter te rusten. De keuze voor deze termijn Tweede Kamer, vergaderjaar , , nr. 6 10
11 berust op de Europese richtlijn klinische proeven (2001/20/EG), zoals hierboven al bij beantwoording van vergelijkbare vragen van de SP-fractie is aangegeven. Om de verrichter in staat te stellen aan deze verplichting te kunnen voldoen, zal deze de informatie zo kort mogelijk na het voorval dienen te ontvangen. De uitvoerder die het ernstige ongewenste voorval waarneemt moet goed in staat worden geacht dit voorval onmiddellijk te melden. Artikel 11 Het valt de leden van de SP-fractie op dat in artikel 11 geen termijnen zijn opgenomen en slechts de term «tijdig» wordt gebezigd. Deze leden vragen of en zo ja, waarom, de regering dit afdoende vindt. Is er geen reden om in het geval het gaat om onaanvaardbare risico s te kiezen voor de term «onmiddellijk» of «zo snel mogelijk», zo vragen zij. Het voorgestelde artikel 11 betreft de algemene informatieplicht van de uitvoerder ten opzichte van proefpersonen en anderen van wie op basis van artikel 6 toestemming vereist is. Het gaat daarbij allereerst om de informatie die voorafgaand aan deelname wordt verschaft omtrent bedenktijd, de mogelijkheid te allen tijde met deelname te kunnen stoppen, de verzekering van schade, de onafhankelijke arts die kan worden geraadpleegd en de wijze waarop de persoonlijke levenssfeer wordt beschermd. Daarnaast gaat het om het verloop van het onderzoek. Dit kunnen hele positieve voortgangsberichten zijn, maar ook negatieve, waaronder in ieder geval situaties begrepen moeten worden waarbij sprake is van onaanvaardbare risico s voor de proefpersoon, zoals omschreven in artikel 10, vierde lid. Voor elk van deze verplichtingen geldt dat deze tijdig moeten worden gedaan. Vanzelfsprekend zal het begrip tijdig in situaties die direct raken aan de veiligheid van de proefpersoon gezien moeten worden in dat licht, en daarmee een verplichting oproepen om dit onverwijld te melden aan de proefpersoon. De invulling van het begrip tijdig is afhankelijk van de urgentie die met de in het specifieke geval relevante informatieplicht samenhangt. De leden van de fractie van D66 wensen te vernemen wat in artikel 11, eerste lid, wordt verstaan on het «tijdig» inlichten van de proefpersoon. Op wat verstaan moet worden onder het tijdig inlichten van proefpersonen, alsook anderen van wie toestemming is vereist, is hierboven reeds ingegaan bij de beantwoording van een soortgelijke vraag van de SP-fractie, zodat daarnaar wordt verwezen. Artikel 13r De leden van de VVD-fractie vragen hoe het mogelijk is dat artikel 13r bij de inwerkingtreding van de wijziging van de WMO op 1 juli 2012 is vervallen, en welke gevolgen dit heeft gehad. Het abusievelijk vervallen van artikel 13r is gebeurd tijdens de parlementaire behandeling van de wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie van richtlijn nr. 2001/20/EG. 2 Het vervallen van de bepaling heeft geen gevolgen gehad voor de meldingspraktijk bij medisch-wetenschappelijk onderzoek. De bepalingen in de Regeling wetenschappelijk onderzoek met geneesmiddelen die betrekking hebben op de meldingsplicht van de artikelen 13o, 13p en 13q zijn uitgewerkt in de digitale meldingsprocedures van ToetsingOnline, de 2 Stb. 2012, 70. Tweede Kamer, vergaderjaar , , nr. 6 11
12 digitale indieningsportal van de CCMO. Van belang is evenwel dat de rechtsgrondslag voor de bepalingen in het besluit wordt hersteld. Daarom zullen, indien het voorstel tot wet wordt verheven, de betreffende bepalingen uit de Regeling wetenschappelijk onderzoek met geneesmiddelen, met terugwerkende kracht, wederom worden vastgesteld. Op die manier wordt eventuele onduidelijkheid over de juridische basis van die bepalingen weggenomen. Artikel 29 De leden van de SP-fractie geven aan niet overtuigd te zijn van het deel van artikel 29 waarin wordt voorkomen dat inspectierapporten niet via een Wob-verzoek openbaar mogen worden ter bescherming van bedrijfsgegevens. Zij vragen of het voorkomen dat concurrentiegevoelige informatie openbaar wordt, niet op gespannen voet staat met het algemeen belang van openbaar worden van mogelijke misstanden bij medischwetenschappelijk onderzoek. Het niet openbaar worden van de inspectierapporten is een technische wijziging ter verbetering van de implementatie van richtlijnen 2001/20/EG en 2005/25/EG. In het bijzonder artikel 30, tweede lid, van laatstgenoemde richtlijn bepaalt dat een inspectieverslag van onderzoek met geneesmiddelen niet aan andere partijen dan de in het nu voorgestelde artikel 29, tweede lid, ter beschikking wordt gesteld. Het is daarmee voor een concurrerende onderneming niet mogelijk om bijvoorbeeld via een Wob-verzoek een inspectieverslag te verkrijgen en op die manier concurrentiegevoelige informatie te verkrijgen. De IGZ beschikt uiteraard over alle informatie die in het inspectieverslag staat en kan in het algemeen toezien op de naleving van de wet. Ik hoop dat ik met het bovenstaande de commissie in voldoende mate heb geantwoord op de verschillende vragen van de diverse fracties. De Minister van Volksgezondheid, Welzijn en Sport, E.I. Schippers Tweede Kamer, vergaderjaar , , nr. 6 12
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814.
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2016 2017 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2016 2017 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal Vergaderjaar 20 202 3 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Eerste Kamer der Staten-Generaal Vergaderjaar 20 202 3 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Officiële uitgave van het Koninkrijk der Nederlanden sinds Gelet op artikel 7.1, eerste en tweede lid, van de Wet luchtvaart;
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 35918 11 juli 2019 Regeling van de Minister van Infrastructuur en Waterstaat, van 27 juni 2019, nr. IENW/BSK-2019/104331,
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 35918 11 juli 2019 Regeling van de Minister van Infrastructuur en Waterstaat, van 27 juni 2019, nr. IENW/BSK-2019/104331,
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2009 200 32 23 XVI Vaststelling van de begrotingsstaten van het Ministerie van Volksgezondheid, Welzijn en Sport (XVI) voor het jaar 200 Nr. 30 BRIEF VAN
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2009 200 32 23 XVI Vaststelling van de begrotingsstaten van het Ministerie van Volksgezondheid, Welzijn en Sport (XVI) voor het jaar 200 Nr. 30 BRIEF VAN
ccmo-richtlijn Externe Toetsing
 Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenter-onderzoek
Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenter-onderzoek
Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen
 Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen In de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) staat: Het is verboden wetenschappelijk onderzoek
Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen In de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) staat: Het is verboden wetenschappelijk onderzoek
De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus EA DEN HAAG. Datum 29 juni 2016 Betreft Kamervragen. Geachte voorzitter,
 > Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
> Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 861 Regels ter implementatie van richtlijn (EU) 2016/681 van het Europees Parlement en de Raad van 27 april 2016 over het gebruik van persoonsgegevens
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 861 Regels ter implementatie van richtlijn (EU) 2016/681 van het Europees Parlement en de Raad van 27 april 2016 over het gebruik van persoonsgegevens
Staatsblad van het Koninkrijk der Nederlanden
 Staatsblad van het Koninkrijk der Nederlanden Jaargang 2014 487 Besluit van 1 december 2014, houdende wijziging van het Besluit medische hulpmiddelen in verband met een verbod op de toepassing van permanente
Staatsblad van het Koninkrijk der Nederlanden Jaargang 2014 487 Besluit van 1 december 2014, houdende wijziging van het Besluit medische hulpmiddelen in verband met een verbod op de toepassing van permanente
Rapport Institutioneel Onderzoek
 Rapport Institutioneel Onderzoek Beleidsterrein patiëntenbeleid / Wet medisch-wetenschappelijk onderzoek met mensen Behorend bij het Basisselectiedocument voor de neerslag van de handelingen van de Medisch
Rapport Institutioneel Onderzoek Beleidsterrein patiëntenbeleid / Wet medisch-wetenschappelijk onderzoek met mensen Behorend bij het Basisselectiedocument voor de neerslag van de handelingen van de Medisch
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 822 Wijziging van het wetsvoorstel in verband met de instelling van het implantatenregister houdende aanpassing van het verbod op de toepassing
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 822 Wijziging van het wetsvoorstel in verband met de instelling van het implantatenregister houdende aanpassing van het verbod op de toepassing
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 34 989 Wijziging van de Wet studiefinanciering 2000 met het oog op het wijzigen van de criteria voor de toekenning van meeneembare studiefinanciering
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 34 989 Wijziging van de Wet studiefinanciering 2000 met het oog op het wijzigen van de criteria voor de toekenning van meeneembare studiefinanciering
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal Vergaderjaar 00 0 3 60 Wijziging van de Embryowet in verband met de evaluatie van deze wet Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT Hieronder zijn opgenomen het advies
Tweede Kamer der Staten-Generaal Vergaderjaar 00 0 3 60 Wijziging van de Embryowet in verband met de evaluatie van deze wet Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT Hieronder zijn opgenomen het advies
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2003 2004 28 804 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen ter implementatie van richtlijn nr. 2001/20/EG inzake de toepassing van
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2003 2004 28 804 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen ter implementatie van richtlijn nr. 2001/20/EG inzake de toepassing van
1. Het verzoek en hetgeen daaraan ten grondslag wordt gelegd
 15 januari 2013 ADVIES (AA12.109) van de Codecommissie op verzoek van [X] op de voet van artikel 59 van het Reglement van de Codecommissie en de Commissie van Beroep van de Stichting Code Geneesmiddelenreclame,
15 januari 2013 ADVIES (AA12.109) van de Codecommissie op verzoek van [X] op de voet van artikel 59 van het Reglement van de Codecommissie en de Commissie van Beroep van de Stichting Code Geneesmiddelenreclame,
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
Wetenschappelijk onderzoek met Karakter
 Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Waarom studies voortijdig stoppen. Job van der Palen METC Twente
 Waarom studies voortijdig stoppen Job van der Palen METC Twente Waarom studies voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring Board (DSMB)
Waarom studies voortijdig stoppen Job van der Palen METC Twente Waarom studies voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring Board (DSMB)
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
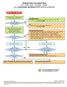 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Wijziging van de Wet studiefinanciering 2000 met het oog op het wijzigen van de criteria voor de toekenning van meeneembare studiefinanciering
 TWEEDE KAMER DER STATEN-GENERAAL Vergaderjaar 2018/19 34 989 Wijziging van de Wet studiefinanciering 2000 met het oog op het wijzigen van de criteria voor de toekenning van meeneembare studiefinanciering
TWEEDE KAMER DER STATEN-GENERAAL Vergaderjaar 2018/19 34 989 Wijziging van de Wet studiefinanciering 2000 met het oog op het wijzigen van de criteria voor de toekenning van meeneembare studiefinanciering
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2016 2017 34 688 Wijziging van Boek 7 van het Burgerlijk Wetboek, de Wet handhaving consumentenbescherming en enige andere wetten in verband met de implementatie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2016 2017 34 688 Wijziging van Boek 7 van het Burgerlijk Wetboek, de Wet handhaving consumentenbescherming en enige andere wetten in verband met de implementatie
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 003 Wijziging van de Wet op het financieel toezicht in verband met het nader regelen van het gebruik van het burgerservicenummer bij de uitvoering
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 003 Wijziging van de Wet op het financieel toezicht in verband met het nader regelen van het gebruik van het burgerservicenummer bij de uitvoering
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2005 2006 30 696 Wijziging van de Wet op de lijkbezorging Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT 1 Hieronder zijn opgenomen het advies van de Raad
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2005 2006 30 696 Wijziging van de Wet op de lijkbezorging Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT 1 Hieronder zijn opgenomen het advies van de Raad
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2002 2003 28 804 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen ter implementatie van richtlijn nr. 2001/20/EG inzake de toepassing van
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2002 2003 28 804 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen ter implementatie van richtlijn nr. 2001/20/EG inzake de toepassing van
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 882 Wijziging van de Wet basisregistratie personen in verband met het opnemen van gegevens over kinderen die op het moment van de geboorte niet
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 882 Wijziging van de Wet basisregistratie personen in verband met het opnemen van gegevens over kinderen die op het moment van de geboorte niet
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2006 2007 29 936 Regels inzake beëdiging, kwaliteit en integriteit van beëdigd vertalers en van gerechtstolken die werkzaam zijn binnen het domein van justitie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2006 2007 29 936 Regels inzake beëdiging, kwaliteit en integriteit van beëdigd vertalers en van gerechtstolken die werkzaam zijn binnen het domein van justitie
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2018 2019 35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) A GEWIJZIGD VOORSTEL VAN WET 16 april 2019
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2018 2019 35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) A GEWIJZIGD VOORSTEL VAN WET 16 april 2019
De rol van de verpleegkundige binnen Medischwetenschappelijk
 De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Klokkenluidersregeling
 REGELING INZAKE HET OMGAAN MET EEN VERMOEDEN VAN EEN MISSTAND HOOFDSTUK 1. DEFINITIES Artikel 1. Definities In deze regeling worden de volgende definities gebruikt: betrokkene: degene die al dan niet in
REGELING INZAKE HET OMGAAN MET EEN VERMOEDEN VAN EEN MISSTAND HOOFDSTUK 1. DEFINITIES Artikel 1. Definities In deze regeling worden de volgende definities gebruikt: betrokkene: degene die al dan niet in
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) Nr. 2 VOORSTEL VAN WET Wij Willem-Alexander,
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) Nr. 2 VOORSTEL VAN WET Wij Willem-Alexander,
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2010 2011 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2010 2011 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2015 2016 34 272 Wijziging van onder meer de Algemene wet erkenning EG-beroepskwalificaties in verband met de implementatie van Richtlijn 2013/55/EU van
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2015 2016 34 272 Wijziging van onder meer de Algemene wet erkenning EG-beroepskwalificaties in verband met de implementatie van Richtlijn 2013/55/EU van
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 016 Regeling van de mogelijke toewijzing van extra zetels voor Nederland in het Europees Parlement Nr. 6 NOTA NAAR AANLEIDING VAN HET VERSLAG
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2018 2019 35 016 Regeling van de mogelijke toewijzing van extra zetels voor Nederland in het Europees Parlement Nr. 6 NOTA NAAR AANLEIDING VAN HET VERSLAG
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
- [ ] of (bijvoorbeeld) [naam gemeente/organisatie] = door gemeente in te vullen, zie bijvoorbeeld artikel 1.
![- [ ] of (bijvoorbeeld) [naam gemeente/organisatie] = door gemeente in te vullen, zie bijvoorbeeld artikel 1. - [ ] of (bijvoorbeeld) [naam gemeente/organisatie] = door gemeente in te vullen, zie bijvoorbeeld artikel 1.](/thumbs/54/34723274.jpg) Voorbeeld Regeling melden vermoeden misstand (Interne klokkenluidersregeling [naam gemeente/organisatie]) BIJLAGE BIJ ECWGO/U201601078 Leeswijzer modelbepalingen - [ ] of (bijvoorbeeld) [naam gemeente/organisatie]
Voorbeeld Regeling melden vermoeden misstand (Interne klokkenluidersregeling [naam gemeente/organisatie]) BIJLAGE BIJ ECWGO/U201601078 Leeswijzer modelbepalingen - [ ] of (bijvoorbeeld) [naam gemeente/organisatie]
INHOUDSOPGAVE. Basis Selectie Document METC s van algemene ziekenhuizen en zelfstandige stichtingen in Nederland, en VU medisch centrum in Amsterdam
 Basisselectiedocument voor Medische Ethische Toetsingscommissies (METC s) van algemene ziekenhuizen en zelfstandige stichtingen in Nederland en VU medisch centrum in Amsterdam Periode 1999 - Versie vastgesteld
Basisselectiedocument voor Medische Ethische Toetsingscommissies (METC s) van algemene ziekenhuizen en zelfstandige stichtingen in Nederland en VU medisch centrum in Amsterdam Periode 1999 - Versie vastgesteld
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2000 2001 27 423 Wet houdende regels inzake handelingen met geslachtscellen en embryo s (Embryowet) Nr. 1 KONINKLIJKE BOODSCHAP Aan de Tweede Kamer der Staten-Generaal
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2000 2001 27 423 Wet houdende regels inzake handelingen met geslachtscellen en embryo s (Embryowet) Nr. 1 KONINKLIJKE BOODSCHAP Aan de Tweede Kamer der Staten-Generaal
NADERE MEMORIE VAN ANTWOORD
 NADERE MEMORIE VAN ANTWOORD De regering heeft met belangstelling kennisgenomen van de vragen en opmerkingen van de leden van de fracties van de PVV, D66, GroenLinks, en Partij voor de Dieren, mede namens
NADERE MEMORIE VAN ANTWOORD De regering heeft met belangstelling kennisgenomen van de vragen en opmerkingen van de leden van de fracties van de PVV, D66, GroenLinks, en Partij voor de Dieren, mede namens
Algemene informatie. Medisch wetenschappelijk onderzoek
 Algemene informatie Medisch wetenschappelijk onderzoek 1 Inleiding Artsen verrichten naast hun normale behandelingen soms medisch wetenschappelijk onderzoek. Dit doen artsen in het Scheper Ziekenhuis Emmen
Algemene informatie Medisch wetenschappelijk onderzoek 1 Inleiding Artsen verrichten naast hun normale behandelingen soms medisch wetenschappelijk onderzoek. Dit doen artsen in het Scheper Ziekenhuis Emmen
Klokkenluidersregeling
 Stichting voor Christelijk Primair Onderwijs Zuid-Kennemerland Klokkenluidersregeling Versie 1 december 2016 NB met het verschijnen van een nieuwe klokkenluidersregeling komt de vorige te vervallen. Wil
Stichting voor Christelijk Primair Onderwijs Zuid-Kennemerland Klokkenluidersregeling Versie 1 december 2016 NB met het verschijnen van een nieuwe klokkenluidersregeling komt de vorige te vervallen. Wil
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek
 Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Toelichting nadere uitwerking van artikel 16 Gedragscode Geneesmiddelenreclame inzake niet-wmo-plichtig onderzoek
 Toelichting nadere uitwerking van artikel 16 Gedragscode Geneesmiddelenreclame inzake niet-wmo-plichtig onderzoek Inleiding 1. De CGR heeft deze Richtlijnen over niet-wmo-plichtig onderzoek vastgesteld
Toelichting nadere uitwerking van artikel 16 Gedragscode Geneesmiddelenreclame inzake niet-wmo-plichtig onderzoek Inleiding 1. De CGR heeft deze Richtlijnen over niet-wmo-plichtig onderzoek vastgesteld
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2001 2002 Nr. 47 27 423 Wet houdende regels inzake handelingen met geslachtscellen en embryo s (Embryowet) GEWIJZIGD VOORSTEL VAN WET 9 oktober 2001 Wij
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2001 2002 Nr. 47 27 423 Wet houdende regels inzake handelingen met geslachtscellen en embryo s (Embryowet) GEWIJZIGD VOORSTEL VAN WET 9 oktober 2001 Wij
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 249 Wijziging van de Zorgverzekeringswet in verband met de verstrekking van bijdragen aan zorgaanbieders die inkomsten derven ten gevolge van
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 249 Wijziging van de Zorgverzekeringswet in verband met de verstrekking van bijdragen aan zorgaanbieders die inkomsten derven ten gevolge van
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 29 544 Arbeidsmarktbeleid Nr. 449 VERSLAG VAN EEN SCHRIFTELIJK OVERLEG Vastgesteld 5 februari 2013 De vaste commissie voor Sociale Zaken en Werkgelegenheid
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 29 544 Arbeidsmarktbeleid Nr. 449 VERSLAG VAN EEN SCHRIFTELIJK OVERLEG Vastgesteld 5 februari 2013 De vaste commissie voor Sociale Zaken en Werkgelegenheid
Convenant Eenvormige Toetsing Gezondheidsonderzoek vanuit het Parelsnoer Instituut
 Convenant Eenvormige Toetsing Gezondheidsonderzoek De ondergetekenden: 1. Academisch Medisch Centrum Amsterdam... gevestigd aan... te..., vertegenwoordigd door... (hierna te noemen...) en 2...., gevestigd
Convenant Eenvormige Toetsing Gezondheidsonderzoek De ondergetekenden: 1. Academisch Medisch Centrum Amsterdam... gevestigd aan... te..., vertegenwoordigd door... (hierna te noemen...) en 2...., gevestigd
Regeling melden vermoeden misstand Werk en Inkomen Lekstroom
 Het dagelijks bestuur van Werk en Inkomen Lekstroom (WIL); gelezen het voorstel van het dagelijks bestuur van 7 september 2017; gelet op de Wet Huis voor klokkenluiders; gelet op artikel 125quinquies Ambtenarenwet;
Het dagelijks bestuur van Werk en Inkomen Lekstroom (WIL); gelezen het voorstel van het dagelijks bestuur van 7 september 2017; gelet op de Wet Huis voor klokkenluiders; gelet op artikel 125quinquies Ambtenarenwet;
Klokkenluidersregeling. van de Universiteit van Amsterdam en de Hogeschool van Amsterdam
 Klokkenluidersregeling van de Universiteit van Amsterdam en de Hogeschool van Amsterdam Amsterdam, 2006 Preambule Klokkenluiden kan worden omschreven als het door een medewerker (de klokkenluider) extern
Klokkenluidersregeling van de Universiteit van Amsterdam en de Hogeschool van Amsterdam Amsterdam, 2006 Preambule Klokkenluiden kan worden omschreven als het door een medewerker (de klokkenluider) extern
Regeling Vermoeden Misstand Metropoolregio Eindhoven 2016
 CVDR Officiële uitgave van Metropoolregio Eindhoven. Nr. CVDR425614_1 28 juni 2017 Regeling Vermoeden Misstand Metropoolregio Eindhoven 2016 Het Dagelijks Bestuur van de Metropoolregio Eindhoven, besluit;
CVDR Officiële uitgave van Metropoolregio Eindhoven. Nr. CVDR425614_1 28 juni 2017 Regeling Vermoeden Misstand Metropoolregio Eindhoven 2016 Het Dagelijks Bestuur van de Metropoolregio Eindhoven, besluit;
Staatsblad van het Koninkrijk der Nederlanden
 Staatsblad van het Koninkrijk der Nederlanden Jaargang 2008 388 Besluit van 28 augustus 2008, houdende wijziging van het Warenwetbesluit attractie- en speeltoestellen (WAS) teneinde regels te stellen over
Staatsblad van het Koninkrijk der Nederlanden Jaargang 2008 388 Besluit van 28 augustus 2008, houdende wijziging van het Warenwetbesluit attractie- en speeltoestellen (WAS) teneinde regels te stellen over
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2004 2005 30 034 Bevordering van het naar arbeidsvermogen verrichten van werk of van werkhervatting van verzekerden die gedeeltelijk arbeidsgeschikt zijn
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2004 2005 30 034 Bevordering van het naar arbeidsvermogen verrichten van werk of van werkhervatting van verzekerden die gedeeltelijk arbeidsgeschikt zijn
Officiële uitgave van het Koninkrijk der Nederlanden sinds Herziene CCMO-richtlijn Beoordeling onderzoekscontracten
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 16713 20 september 2011 Herziene CCMO-richtlijn Beoordeling onderzoekscontracten 30 augustus 2011 Richtlijn van de centrale
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 16713 20 september 2011 Herziene CCMO-richtlijn Beoordeling onderzoekscontracten 30 augustus 2011 Richtlijn van de centrale
Klokkenluiderregeling
 Klokkenluiderregeling Versie 2015 Gedragscode PGGM Inhoudsopgave 1 Inleiding en uitgangspunten 3 1.1 Inleiding 3 1.2 Uitgangspunten 3 1.2.1 Algemeen 3 1.2.2 Misstanden 3 1.2.3 Uitgangspunten uitvoering
Klokkenluiderregeling Versie 2015 Gedragscode PGGM Inhoudsopgave 1 Inleiding en uitgangspunten 3 1.1 Inleiding 3 1.2 Uitgangspunten 3 1.2.1 Algemeen 3 1.2.2 Misstanden 3 1.2.3 Uitgangspunten uitvoering
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal Vergaderjaar 010 011 3 830 Wijziging van de Wegenverkeerswet 1994 en de Wet rijonderricht motorrijtuigen 1993 in verband met de implementatie van de derde rijbewijsrichtlijn
Tweede Kamer der Staten-Generaal Vergaderjaar 010 011 3 830 Wijziging van de Wegenverkeerswet 1994 en de Wet rijonderricht motorrijtuigen 1993 in verband met de implementatie van de derde rijbewijsrichtlijn
Klokkenluidersregeling. Volkshuisvesting Arnhem
 Klokkenluidersregeling Volkshuisvesting Arnhem Status: definitief Arnhem, 17 januari 2007 Auteur: Raymond Rensen Vastgesteld door Gerrit Breeman d.d. : 31-1-2007 INHOUDSOPGAVE Vooraf...3 Hoofdstuk 1. Definities...4
Klokkenluidersregeling Volkshuisvesting Arnhem Status: definitief Arnhem, 17 januari 2007 Auteur: Raymond Rensen Vastgesteld door Gerrit Breeman d.d. : 31-1-2007 INHOUDSOPGAVE Vooraf...3 Hoofdstuk 1. Definities...4
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2008 2009 32 047 Goedkeuring van verdragen met het oog op het voornemen deze toe te passen op Bonaire, Sint Eustatius en Saba, en van het voornemen tot opzegging
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2008 2009 32 047 Goedkeuring van verdragen met het oog op het voornemen deze toe te passen op Bonaire, Sint Eustatius en Saba, en van het voornemen tot opzegging
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2016 2017 Aanhangsel van de Handelingen Vragen gesteld door de leden der Kamer, met de daarop door de regering gegeven antwoorden 898 Vragen van het lid
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2016 2017 Aanhangsel van de Handelingen Vragen gesteld door de leden der Kamer, met de daarop door de regering gegeven antwoorden 898 Vragen van het lid
Lijst van vragen - totaal
 Lijst van vragen - totaal Kamerstuknummer : 33149-30 Vragen aan Commissie : Regering : Volksgezondheid, Welzijn en Sport 33 149 Inspectie voor de Gezondheidszorg (IGZ) LIJST VAN VRAGEN EN ANTWOORDEN Vastgesteld------------------
Lijst van vragen - totaal Kamerstuknummer : 33149-30 Vragen aan Commissie : Regering : Volksgezondheid, Welzijn en Sport 33 149 Inspectie voor de Gezondheidszorg (IGZ) LIJST VAN VRAGEN EN ANTWOORDEN Vastgesteld------------------
Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente
 Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente Waarom voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring
Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente Waarom voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring
Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Beleidskader intrekken erkenning als Jobcoachorganisatie
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 13672 27 mei 2013 Beleidskader intrekken erkenning als Jobcoachorganisatie Het Uitvoeringsinstituut werknemersverzekeringen,
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 13672 27 mei 2013 Beleidskader intrekken erkenning als Jobcoachorganisatie Het Uitvoeringsinstituut werknemersverzekeringen,
REGELING MELDEN VERMOEDEN MISSTAND
 REGELING MELDEN VERMOEDEN MISSTAND Artikel 1 Begripsbepalingen In deze regeling wordt verstaan onder: werknemer: de persoon die werkt of heeft gewerkt voor de Veiligheidsregio Utrecht zoals bedoeld in
REGELING MELDEN VERMOEDEN MISSTAND Artikel 1 Begripsbepalingen In deze regeling wordt verstaan onder: werknemer: de persoon die werkt of heeft gewerkt voor de Veiligheidsregio Utrecht zoals bedoeld in
Staatsblad van het Koninkrijk der Nederlanden
 Staatsblad van het Koninkrijk der Nederlanden Jaargang 2003 488 Besluit van 21 november 2003 tot uitvoering van artikel 8, tweede lid, van de Wet melding ongebruikelijke transacties, houdende goedkeuring
Staatsblad van het Koninkrijk der Nederlanden Jaargang 2003 488 Besluit van 21 november 2003 tot uitvoering van artikel 8, tweede lid, van de Wet melding ongebruikelijke transacties, houdende goedkeuring
2 Vergaderjaar
 T WEEDE K AMER DER STATEN-G ENERAAL 2 Vergaderjaar 2005-2006 30 696 Wijziging van de Wet op de lijkbezorging Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT 1 Hieronder zijn opgenomen het advies van de Raad
T WEEDE K AMER DER STATEN-G ENERAAL 2 Vergaderjaar 2005-2006 30 696 Wijziging van de Wet op de lijkbezorging Nr. 4 ADVIES RAAD VAN STATE EN NADER RAPPORT 1 Hieronder zijn opgenomen het advies van de Raad
De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus EA DEN HAAG. Datum 4 februari 2016 Betreft Kamervragen. Geachte voorzitter,
 > Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
> Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek
 Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Centrum klinische farmacologie: deelnemen aan een klinische studie
 Centrum klinische farmacologie: deelnemen aan een klinische studie informatie voor gezonde proefpersonen en patïenten INLEIDING 3 KLINISCHE STUDIES: EEN INLEIDING 4 De ontwikkeling van een nieuw geneesmiddel
Centrum klinische farmacologie: deelnemen aan een klinische studie informatie voor gezonde proefpersonen en patïenten INLEIDING 3 KLINISCHE STUDIES: EEN INLEIDING 4 De ontwikkeling van een nieuw geneesmiddel
Wat is een klinische studie?
 Wat is een klinische studie? Klinische studies Klinische studies Klinische studies worden verricht om de werkzaamheid van geneesmiddelen alsook combinaties van verschillende behandelingen te testen. Klinische
Wat is een klinische studie? Klinische studies Klinische studies Klinische studies worden verricht om de werkzaamheid van geneesmiddelen alsook combinaties van verschillende behandelingen te testen. Klinische
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek
 Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek Titel van het onderzoek: Sneller behandelen van patiënten met een acute beroerte door een volgsysteem met directe visuele feedback
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2007 2008 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 849 Wijziging van de Wet op het financieel toezicht en enige andere wetten ter implementatie van richtlijn 2013/36/EU van het Europees Parlement
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 849 Wijziging van de Wet op het financieel toezicht en enige andere wetten ter implementatie van richtlijn 2013/36/EU van het Europees Parlement
Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen)
 35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) NOTA VAN WIJZIGING Het voorstel van wet wordt als volgt gewijzigd: A In artikel 3, tweede lid, aanhef,
35 043 Regels over de veiligheid en kwaliteit van medische hulpmiddelen (Wet medische hulpmiddelen) NOTA VAN WIJZIGING Het voorstel van wet wordt als volgt gewijzigd: A In artikel 3, tweede lid, aanhef,
Toelichting bij de richtlijn inzake de toetsingsprocedure multicenter-onderzoek en
 Toelichting bij de richtlijn inzake de toetsingsprocedure multicenter-onderzoek en externe toetsing van monocenter-onderzoek (Richtlijn Externe Toetsing) Inleiding Op 1 januari 2001 is de Richtlijn van
Toelichting bij de richtlijn inzake de toetsingsprocedure multicenter-onderzoek en externe toetsing van monocenter-onderzoek (Richtlijn Externe Toetsing) Inleiding Op 1 januari 2001 is de Richtlijn van
Hierbij zend ik u de antwoorden op de vragen van het Kamerlid De Lange (VVD) over Nederlandse patiëntgegevens in Belgische gevangenis (2016Z01580).
 > Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
> Retouradres Postbus 20350 2500 EJ Den Haag De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Bezoekadres: Parnassusplein 5 2511 VX Den Haag T 070 340 79 11 F 070 340
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 867 Wijziging van enkele wetten op het terrein van de volksgezondheid in verband met het invoeren van de mogelijkheid tot het heffen van kostendekkende
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 867 Wijziging van enkele wetten op het terrein van de volksgezondheid in verband met het invoeren van de mogelijkheid tot het heffen van kostendekkende
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 779 Wijziging van de Wet kabelbaaninstallaties in verband met Verordening (EU) nr. 2016/424 van het Europees Parlement en de Raad van 9 maart
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2017 2018 34 779 Wijziging van de Wet kabelbaaninstallaties in verband met Verordening (EU) nr. 2016/424 van het Europees Parlement en de Raad van 9 maart
