INCLUSIE SET PLAATS HIER DE PATIENTSTICKER VAN DE GEINCLUDEERDE PATIENT. ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 1 van 9
|
|
|
- Leopold ter Linde
- 5 jaren geleden
- Aantal bezoeken:
Transcriptie
1 INCLUSIE SET Als de patiënt geïncludeerd kan worden in de studie, voert de arts in het behandelcentrum de randomisatieprocedure uit na telefonische aanmelding van de patiënt(e) PLAATS HIER DE PATIENTSTICKER VAN DE GEINCLUDEERDE PATIENT ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 1 van 9
2 INCLUSIE Vaststellen van subarachnoïdale bloeding: Ziekenhuis van eerste presentatie: Datum van eerste presentatie SEH: van presentatie SEH Datum en tijdstip van subarachnoïdale bloeding: onbekend* onbekend* Dit is een betreft een exacte datum/tijd geschatte datum/tijd *Alleen als de datum en tijd van de subarachnoïdale bloeding onbekend zijn, vul dan onderstaande items in, anders doorgaan met de vraag op de volgende pagina: Laatste datum en tijd gezond gezien: Datum en tijd van aantreffen: Zie volgende pagina voor noteren uitkomst randomisatie ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 2 van 9
3 INCLUSIE Uitkomst van randomisatie: medicatie* *voor de bereiding zie bijgevoegde Medicatie instructie. standaard behandeling STOP medicatietoediening als patiënt(e) voor behandeling van het aneurysma gaat (Coiling/Clipping) Wanneer geloot is voor standaard behandeling, ga verder op pagina 5. Bolus toediening van tranexaminezuur (TXA): TXA Chargenr. Ampul 1 TXA Vervaldatum Ampul 2 Paraaf verpleegkundige Is de bolus in 10 minuten ingelopen? Ja Nee, omdat Start van continue toediening van tranexaminezuur: TXA Chargenr. Ampul 1 TXA Vervaldatum Ampul 2 Paraaf verpleegkundige Einde van toediening van eerste continue gift tranexaminezuur (indien gestopt tijdens deze opname): Nog niet gestopt bij overplaatsing naar behandelcentrum, ga verder na pagina 5 ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 3 van 9
4 INCLUSIE Start van toediening van tweede continue gift tranexaminezuur (indien gestart tijdens deze opname): TXA Chargenr. Ampul 1 TXA Vervaldatum Ampul 2 Paraaf verpleegkundige Geen tweede gift ontvangen bij deze opname Einde van toediening van tweede continue gift tranexaminezuur (indien gestopt tijdens deze opname): Nog niet gestopt bij overplaatsing naar behandelcentrum Start van toediening van derde continue gift tranexaminezuur (indien gestart tijdens deze opname): TXA Chargenr. Ampul 1 TXA Vervaldatum Ampul 2 Paraaf verpleegkundige Geen derde gift ontvangen bij deze opname Einde van toediening van derde continue gift tranexaminezuur (indien gestopt tijdens deze opname): ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 4 van 9
5 INCLUSIE Zijn er afwijkingen geweest van het protocol mbt het toedienen van de tranexaminezuur (bijvoorbeeld veranderingen in loopsnelheid van het infuus, tussentijds stopzetten van het infuus, het opnieuw moeten vervaardigen van de studiemedicatie)? Ja Nee Onbekend Zo ja, welke? Is er in de periode tussen de opname in het ziekenhuis en het moment voor overplaatsing naar het behandelcentrum sprake geweest van verslechtering leidend tot: Levensbedreigende situatie Verlengde ziekenhuisopname Overlijden Ja Nee Indien Ja bij één van bovenstaande vragen, vul na dit formulier een ADVERSE EVENT formulier in. VERKLARING LOKALE ONDERZOEKER / ARTS Hierbij verklaar ik dat alle gegevens betreffende de INCLUSIE naar waarheid zijn ingevuld en op compleetheid en accuraatheid zijn gecontroleerd. Naam behandelend arts: Handtekening: Graag ingevulde formulieren inclusief CD-ROM met beeldvorming, verwijsbrief meegeven met patiënt ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 5 van 9
6 ADVERSE EVENT Indien er sprake is van een Serious Adverse Event (SAE), meldt dit dat binnen 24 uur aan het coördinerend centrum via Voor elk afzonderlijk Adverse Event dient een apart formulier te worden ingevuld ADVERSE EVENTS* Omschrijving (diagnose (indien bekend) of verschijnselen/symptomen) Begin datum, tijd 2 Intensiteit 4 Relatie met studiemedicatie Eind datum, tijd 2 OF doorgaand 3 Actie studiemedicatie Overige actie Ο Rebleed Ο Ernstige hyponatriemie (bij tenminste één meting <125 mmol/l) Ο Hydrocephalus Ο DCI Ο Trombo-embolische complicatie, namelijk Ο Pneumonie Ο Meningitis Ο Overig Begin - -, : d d - m m m - j j j j u u : m m Eind - -, : d d - m m m - j j j j u u : m m OF Ο doorgaand 3 aan het einde van de studie. Ο mild Ο matig Ο ernstig Ο niet gerelateerd Ο onwaarschijnlijk Ο mogelijk Ο waarschijnlijk Ο zeker Ο niet te beoordelen Ο geen Ο tijdelijk gestopt Ο blijvend gestopt Ο dosis verlaagd Ο dosis verhoogd Ο onbekend Ο niet van toepassing 6 Ο geen Ο comedicatie: vul in bij klinische opname Ο (verlenging van) ziekenhuisopname Ο anders, specificeer: Ο onbekend Ο niet van toepassing 6 Uitkomst Serious Adverse Event? 5,# (vink 1 of meer antwoordopties aan) Verwacht? 7 Ο hersteld Ο niet hersteld Indien gestabiliseerd, stabilisatiedatum: - - d d - m m m - j j j j Ο herstellende Ο hersteld met restverschijnselen Ο fataal, overlijdensdatum: - - d d - m m m - j j j j) Ο onbekend Ο Ja, specificeer: Ο Nee resulteert in overlijden levensbedreigend (verlenging van) ziekenhuisopname blijvende of ernstige invaliditeit/arbeidsongeschiktheid aangeboren afwijking/geboorteafwijking andere gebeurtenis van medisch belang: *: De studieperiode gedurende welke ongewenste voorvallen gerapporteerd dienen te worden, is normaliter gedefinieerd als de periode vanaf het moment van tekenen van het informed consent tot het einde van de studie interventie follow-up periode. ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 6 van 9 Ο ja Ο nee Ο nvt
7 ADVERSE EVENT #: Elk voorval dat voldoet aan de definitie van een SAE dient gemeld te worden zoals is beschreven in het studieprotocol. VERKLARING LOKALE ONDERZOEKER Hierbij verklaar ik dat alle gegevens betreffende de ADVERSE EVENT naar waarheid zijn ingevuld en op compleetheid en accuraatheid gecontroleerd zijn. Naam lokale onderzoeker: Handtekening: ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 7 van 9
8 ADVERSE EVENT TOELICHTING EN OPMERKINGEN Algemeen Deze pagina is niet gekoppeld aan een visite. Plaats deze achter in het CRF voor de Einde Studie visite. Lay-out: Selectierondjes Ο (zgn. radiobuttons) worden gebruikt voor antwoordcategorieën met slechts één antwoordoptie. Selectievakjes (zgn. check boxes) worden gebruikt voor antwoordcategorieën met meerdere antwoordopties. Open invulhokjes (zgn. combs) zijn van toepassing voor open numerieke antwoorden. Inhoud: Ter bescherming van de privacy van de proefpersoon dienen onderzoeksgegevens gecodeerd aan de hand van een uniek studienummer (Patiënt Identificatie Nummer) in het CRF, de onderzoeksdatabase of webquestionnaire vastgelegd te worden. Een aparte sleuteltabel, waarin persoonsgegevens en studienummer zijn opgenomen, maakt herleiding weer mogelijk. Deze sleuteltabel moet op een beveiligde locatie staan, los van de database en alleen voor bevoegden toegankelijk. In geval van multicenter studies dient deze sleuteltabel dus op locatie bewaard en beheerd te worden. 1 : Het Patiënt Identificatie Nummer is een uniek nummer (alleen cijfers of een combinatie van letters en cijfers) dat bovenaan elke CRF-pagina vermeld moet worden. De lengte van het nummer kan aangepast worden. 2 : Registratie van de begin- en eindtijd (24 uur klok) van een AE is alleen van toepassing als de tijd nauwkeurig kan worden bepaald en er een wetenschappelijke reden is om dit detailniveau te registreren/vast te leggen. 3 : Doorgaand is alleen van toepassing indien aan het eind van de studie het ongewenste voorval nog niet beëindigd is en daarom geen einddatum gegeven kan worden. Elk ongewenste voorval dat nog aanwezig is aan het einde van de studie dient gevolgd te worden totdat er een finale uitkomstclassificatie mogelijk is. Elk ernstig ongewenste voorval (SAE/SUSAR) dat optreedt na afloop van de studie en waarvan een vermoeden bestaat dat er een relatie bestaat met het gebruik van de studiemedicatie of met de studiedeelname dient geregistreerd en gemeld te worden. 4 : De term "Intensiteit" wordt gebruikt om de intensiteit (ernst) van een specifiek voorval aan te duiden (zoals een mild, matig, ernstig myocard infarct). Het voorval zelf, echter, kan slechts van weinig significante medische betekenis zijn (zoals een ernstige hoofdpijn). Dit is niet hetzelfde als ernstig in een ernstig ongewenst voorval (SAE), wat verwijst naar de uitkomst van of de noodzakelijke actie voor gebeurtenissen, die een bedreiging vormen voor het leven of functioneren van een patiënt. ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 8 van 9
9 ADVERSE EVENT Een verandering in de intensiteit van een ongewenst voorval dient vastgelegd te worden als een nieuw voorval. Indien tijdens de studie een verslechtering optreedt van een voorval welke voor aanvang van de studie al aanwezig was, dient deze als een nieuw voorval geregistreerd te worden (met de datum van optreden van de verslechtering als de juiste begindatum). 5 : Een ongewenst voorval is een Serious Adverse Event (SAE, Ernstig Ongewenst Voorval) indien deze: - de dood tot gevolg heeft; - levensbedreigend is (op het moment van het voorval); - een niet geplande ziekenhuisopname of verlenging van een opname noodzakelijk maakt; - tot blijvende of ernstige invaliditeit leidt; - zich uit in een aangeboren afwijking/geboorteafwijking; - een ander ernstig medisch voorval is die niet direct dodelijk, levensbedreigend of ziekenhuisopname noodzakelijk maakt maar die, naar de mening van een arts, een medische of chirurgische interventie vereist om één van bovengenoemde voorvallen te voorkomen. (zie ICH-richtsnoer E2A Guideline for Clinical Safety data Management: Definitions and standards for expedited reporting). Elk voorval dat voldoet aan de definitie van een SAE dient gemeld te worden zoals beschreven in het studieprotocol. 6 : De antwoordcategorieën zijn gebaseerd op de ICH E2B classificatie. Niet van toepassing dient gebruikt te worden indien de patiënt is overleden of de duur van de behandelingsperiode met studiemedicatie reeds was beëindigd voordat het ongewenste voorval optrad (dit laatste voorbeeld geldt dus alleen voor het item Actie studiemedicatie ). 7 : Een ongewenst voorval is een onverwachte bijwerking als het een voorval betreft waarvan het vermoeden bestaat dat er een relatie is met het gebruik van de studiemedicatie en waarvan de aard en ernst niet overeenstemmen met de bekende informatie over de studiemedicatie (Investigator s brochure in het geval van een niet geregistreerd geneesmiddel of SPC tekst in het geval van een geregistreerd geneesmiddel).een onverwachte ernstige bijwerking is een SUSAR (Suspected Unexpected Serious Adverse Reaction ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 9 van 9
10 Subarachnoidale bloeding? ULTRA Medicatie instructie OPLAADDOSIS TRANEXAMINEZUUR (CYKLOKAPRON) 2 ampullen tranexaminezuur 500 mg in 5 ml (1000mg) Oplossen in 100 ml NaCl 0.9% Chargenummers en vervaldatum noteren in inclusie-set Inloop jd: 10 min ONDERHOUDSDOSIS* TRANEXAMINEZUUR (CYKLOKAPRON) 2 ampullen tranexaminezuur 500 mg in 5 ml (1000mg) Oplossen in 500 ml NaCl 0.9% (infuuszak) Chargenummers en vervaldatum noteren in inclusie-set Inloop jd: 8 uur *Indien een spuitenpomp gewenst is dan kan 1000mg tranexaminezuur opgelost worden in 50ml NaCl 0.9%.
ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage
 ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Werkinstructies adverse events rapportage STOP-BPD studie
 Werkinstructies adverse events rapportage STOP-BPD studie De STOP-BPD studie wordt uitgevoerd bij extreem prematuur geboren kinderen die los van deelname aan de studie een continu verhoogd risico hebben
Werkinstructies adverse events rapportage STOP-BPD studie De STOP-BPD studie wordt uitgevoerd bij extreem prematuur geboren kinderen die los van deelname aan de studie een continu verhoogd risico hebben
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
De rol van de verpleegkundige binnen Medischwetenschappelijk
 De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
1. Inloggen. 1.1 Eerste keer inloggen
 . Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
. Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
CRF. Ladies trial. Randomisatienummer
 CRF de Ladies trial Laparoscopische peritoneale lavage of resectie voor gegeneraliseerde peritonitis voor geperforeerde diverticulitis: een landelijke multicentrum gerandomiseerde trial Sandra Vennix (AMC/Erasmus
CRF de Ladies trial Laparoscopische peritoneale lavage of resectie voor gegeneraliseerde peritonitis voor geperforeerde diverticulitis: een landelijke multicentrum gerandomiseerde trial Sandra Vennix (AMC/Erasmus
Onderstaande vragen zijn van toepassing op de periode 6-12 maanden postoperatief
 9. Follow-up Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 6- postoperatief Is de patient opgenomen geweest
9. Follow-up Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 6- postoperatief Is de patient opgenomen geweest
ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage
 ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
STATEC trial praktische uitvoering Hilde Dijcker
 STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage
 ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
ULTRA CRF INVULINSTRUCTIES ULTRA Ultra-early tranexamic acid after subarachnoid hemorrhage CASE RECORD FORM INSTRUCTIES Dit Case Record Form (CRF) moet worden ingevuld door de behandelend arts die bekend
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
Case Record Form (CRF)
 Case Record Form (CRF) POINTER trial: postponed or immediate catheter drainage of infected necrotizing pancreatitis Studiearm UITGESTELDE katheterdrainage / Studienummer POINT Datacenter Pancreatitis Werkgroep
Case Record Form (CRF) POINTER trial: postponed or immediate catheter drainage of infected necrotizing pancreatitis Studiearm UITGESTELDE katheterdrainage / Studienummer POINT Datacenter Pancreatitis Werkgroep
Onderstaande vragen zijn van toepassing op de periode maanden postoperatief
 9. Follow-up Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 12- postoperatief Is de patient opgenomen geweest
9. Follow-up Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 12- postoperatief Is de patient opgenomen geweest
Onderstaande vragen zijn van toepassing op de periode 4-6 maanden postoperatief
 Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 4- postoperatief Is de patient opgenomen geweest in een van
Aantal maanden? Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 4- postoperatief Is de patient opgenomen geweest in een van
COLOPEC trial. 9. Follow-up 2/3/4/5 jaar na primaire resectie. Anamnese. Lichamelijk onderzoek. Labwaarden. Patiënt Identificatie Nummer: Initialen:
 Aantal maanden? maanden Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 18- postoperatief Is de patient opgenomen geweest in
Aantal maanden? maanden Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 18- postoperatief Is de patient opgenomen geweest in
Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) adres (t.b.v. versturen elektronische _
 CRF TUBA-09- _ Ziekenhuis: Pagina 1 van 14 Inclusie Studienummer Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) TUBA-09- _ E-mailadres (t.b.v. versturen elektronische vragenlijsten) @:
CRF TUBA-09- _ Ziekenhuis: Pagina 1 van 14 Inclusie Studienummer Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) TUBA-09- _ E-mailadres (t.b.v. versturen elektronische vragenlijsten) @:
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
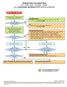 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
CRF-6 Patient Identification Number:
 Postoperatieve complicaties Pag 1 van 4 datum: naar: O Thuissituatie zonder zorg O Thuissituatie met mantelzorg O Thuissituatie met thuiszorg O Extramurale instelling (verzorgings- / verpleeghuis) Postoperatieve
Postoperatieve complicaties Pag 1 van 4 datum: naar: O Thuissituatie zonder zorg O Thuissituatie met mantelzorg O Thuissituatie met thuiszorg O Extramurale instelling (verzorgings- / verpleeghuis) Postoperatieve
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Onderstaande vragen zijn van toepassing op de periode 0-3 maanden postoperatief
 Aantal maanden? Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 0- postoperatief Is de patient opgenomen geweest in een van de volgende
Aantal maanden? Setting: O klinisch O poliklinisch Beoordelaar: (naam) Algemeen Onderstaande vragen zijn van toepassing op de periode 0- postoperatief Is de patient opgenomen geweest in een van de volgende
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding. De ULTRA-studie
 Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) adres (t.b.v. versturen elektronische _
 CRF TUBA-09- _ Ziekenhuis: Pagina 1 van Inclusie Studienummer TUBA-09- _ Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) E-mailadres (t.b.v. versturen elektronische vragenlijsten) @: _ Inclusiecriteria
CRF TUBA-09- _ Ziekenhuis: Pagina 1 van Inclusie Studienummer TUBA-09- _ Geboortedatum (dd-mm-jjjj) Datum informed consent (dd-mm-jjjj) E-mailadres (t.b.v. versturen elektronische vragenlijsten) @: _ Inclusiecriteria
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding. De ULTRA-studie
 Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
1. Voorafgaand aan de klinische fase van het onderzoek
 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
3. Maand (België) Patiënt getransplanteerd Anders 1b. Indien Intrekken toestemming, datum
 Page 1 of 14 3. Maand 3-9-15-21 (België) H. Visit 1. Betreft visit Screening Week 1-4 Maand 3 Maand 6 Maand 9 Maand 12 Maand 15 Maand 18 Maand 21 Maand 24 2. Datum visit / / I. Patiënt informatie 1. Initialen
Page 1 of 14 3. Maand 3-9-15-21 (België) H. Visit 1. Betreft visit Screening Week 1-4 Maand 3 Maand 6 Maand 9 Maand 12 Maand 15 Maand 18 Maand 21 Maand 24 2. Datum visit / / I. Patiënt informatie 1. Initialen
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Follow-up na: maanden Datum: - - d d m m m j j j j. Voor de wondscore: (naam)
 Follow-up na: maanden Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Voor de wondscore: (naam) Functie beoordelaar: O Geblindeerde (stoma-)verpleegkundige,o Geblindeerde arts-assistent,
Follow-up na: maanden Datum: Setting: O klinisch O poliklinisch Beoordelaar: (naam) Voor de wondscore: (naam) Functie beoordelaar: O Geblindeerde (stoma-)verpleegkundige,o Geblindeerde arts-assistent,
PATIËNTEN INFORMATIE BRIEF PROSPECTIEVE DATA REGISTRATIE VAN PATIËNTEN MET EEN AANGEBOREN ZELDZAME STOLLINGSAFWIJKING (PRO-RBDD)
 PATIËNTEN INFORMATIE BRIEF PROSPECTIEVE DATA REGISTRATIE VAN PATIËNTEN MET EEN AANGEBOREN ZELDZAME STOLLINGSAFWIJKING (PRO-RBDD) Geachte mevrouw / mijnheer, Uw behandelend arts heeft u geïnformeerd over
PATIËNTEN INFORMATIE BRIEF PROSPECTIEVE DATA REGISTRATIE VAN PATIËNTEN MET EEN AANGEBOREN ZELDZAME STOLLINGSAFWIJKING (PRO-RBDD) Geachte mevrouw / mijnheer, Uw behandelend arts heeft u geïnformeerd over
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
HOVON 141 CLL. Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF
 Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Template protocol (medisch) wetenschappelijk onderzoek met bestaande (patiënten)gegevens (niet-wmo) (versie mei 2016)
 Template protocol (medisch) wetenschappelijk onderzoek met bestaande (patiënten)gegevens (niet-wmo) (versie mei 2016) CME LUMC 1. Informatie over onderzoeker en opdrachtgever 1.1 Titel onderzoek 1.2 protocol
Template protocol (medisch) wetenschappelijk onderzoek met bestaande (patiënten)gegevens (niet-wmo) (versie mei 2016) CME LUMC 1. Informatie over onderzoeker en opdrachtgever 1.1 Titel onderzoek 1.2 protocol
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Interklinische PCI. Verpleegafdeling cardiologie (tel ) / CCU (tel ) * Naam verpleegkundige:
 Verpleegafdeling cardiologie (tel 010-461 6338) / CCU (tel 010-4616218) * Naam verpleegkundige: Patiënten Identificatiesticker verwijzend ziekenhuis *svp doorhalen wat niet van toepassing is Medium care
Verpleegafdeling cardiologie (tel 010-461 6338) / CCU (tel 010-4616218) * Naam verpleegkundige: Patiënten Identificatiesticker verwijzend ziekenhuis *svp doorhalen wat niet van toepassing is Medium care
APEC-trial. Case Record Form. Acute biliary Pancreatitis: early ERC plus sphincterotomy versus Conservative treatment
 APEC-trial Case Record Form Acute biliary Pancreatitis: early ERC plus sphincterotomy versus Conservative treatment Groep A: ERC (met sphincterotomie) Patiëntensticker Bel s.v.p. op volgorde 1-4 1. Noortje
APEC-trial Case Record Form Acute biliary Pancreatitis: early ERC plus sphincterotomy versus Conservative treatment Groep A: ERC (met sphincterotomie) Patiëntensticker Bel s.v.p. op volgorde 1-4 1. Noortje
Analyse medicatiebeoordelingen t.b.v. de KNMP Richtlijn Medicatiebeoordeling september 2012
 Analyse medicatiebeoordelingen t.b.v. de KNMP Richtlijn Medicatiebeoordeling september 2012 Voorwoord Ter ondersteuning van de KNMP richtlijn Medicatiebeoordeling heeft Service Apotheek in samenwerking
Analyse medicatiebeoordelingen t.b.v. de KNMP Richtlijn Medicatiebeoordeling september 2012 Voorwoord Ter ondersteuning van de KNMP richtlijn Medicatiebeoordeling heeft Service Apotheek in samenwerking
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Factsheet Indicatoren CVA (CVAB) 2016
 Factsheet en CVA (CVAB) 2016 Registratie gestart: 2014 In- en exclusiecriteria Definities: - CVA (Beroerte): intracerebrale bloeding of herseninfarct. - Intracerebrale bloeding: spontane bloeding in het
Factsheet en CVA (CVAB) 2016 Registratie gestart: 2014 In- en exclusiecriteria Definities: - CVA (Beroerte): intracerebrale bloeding of herseninfarct. - Intracerebrale bloeding: spontane bloeding in het
Case Report Form (CRF) behorende bij de SASIV-study
 Case Report Form (CRF) behorende bij de SASIV-study Inclusiecriteria 0 70 jaar of ouder 0 Acute opgenomen op de longgeneeskunde of chirurgie 0 Spreekt en verstaat Nederlands 0 Komt niet van andere afdeling
Case Report Form (CRF) behorende bij de SASIV-study Inclusiecriteria 0 70 jaar of ouder 0 Acute opgenomen op de longgeneeskunde of chirurgie 0 Spreekt en verstaat Nederlands 0 Komt niet van andere afdeling
Factsheet Indicatoren CVA (CVAB) 2017 Versie: 2017 Registratie gestart: 2014
 Factsheet en CVA (CVAB) 2017 Versie: 2017 Registratie gestart: 2014 Versie 2017 pagina 1 van 8 enoverzicht CVAB 2017 Nr. Type Uitvraag Bron indicator over (jaar) 1. Aantal klinisch opgenomen CVA-patiënten,
Factsheet en CVA (CVAB) 2017 Versie: 2017 Registratie gestart: 2014 Versie 2017 pagina 1 van 8 enoverzicht CVAB 2017 Nr. Type Uitvraag Bron indicator over (jaar) 1. Aantal klinisch opgenomen CVA-patiënten,
Indien van toepassing (bij primaire resectie en HIPEC in dezelfde opname): Operatiedatum 2e OK: d d m m m j j j j. dagen
 Reden van opname Type operatie: Meerdere antwoorden mogelijk O Primaire resectie coloncarcinoom O Primaire resectie coloncarcinoom met simultane HIPEC O HIPEC in later stadium O Diagnostische laparoscopie
Reden van opname Type operatie: Meerdere antwoorden mogelijk O Primaire resectie coloncarcinoom O Primaire resectie coloncarcinoom met simultane HIPEC O HIPEC in later stadium O Diagnostische laparoscopie
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
Richtlijn Melden van ernstige bijwerkingen van Vitamine K-antagonisten door de Nederlandse trombosediensten bij Lareb
 Richtlijn Melden van ernstige bijwerkingen van Vitamine K-antagonisten door de Nederlandse trombosediensten bij Lareb Deze richtlijn is een initiatief van de Federatie van Nederlandse Trombosediensten
Richtlijn Melden van ernstige bijwerkingen van Vitamine K-antagonisten door de Nederlandse trombosediensten bij Lareb Deze richtlijn is een initiatief van de Federatie van Nederlandse Trombosediensten
Factsheet Indicatoren Geïnstrumenteerde Lage Rug Chirurgie (DSSR) 2016
 Factsheet en Geïnstrumenteerde Lage Rug Chirurgie (DSSR) 2016 Registratie gestart: 2014 Inclusie en exclusie criteria Inclusie Alle patienten met een degeneratieve lumbale wervelkolomaandoening die een
Factsheet en Geïnstrumenteerde Lage Rug Chirurgie (DSSR) 2016 Registratie gestart: 2014 Inclusie en exclusie criteria Inclusie Alle patienten met een degeneratieve lumbale wervelkolomaandoening die een
Factsheet Indicatoren Bariatrische Chirurgie (DATO) Start registratie: 2014
 Factsheet en Bariatrische Chirurgie (DATO) 2017 Start registratie: 2014 Inclusie & exclusie criteria DATO Inclusie De patiënten die geregistreerd dienen te worden zijn die patiënten die een chirurgische
Factsheet en Bariatrische Chirurgie (DATO) 2017 Start registratie: 2014 Inclusie & exclusie criteria DATO Inclusie De patiënten die geregistreerd dienen te worden zijn die patiënten die een chirurgische
SOP: Lokale werkwijze MR ASAP
 SOP: Lokale werkwijze MR ASAP SOP: L01 Versie Nr.: 1.1 Geldig m.i.v.: 17-09-2018 Auteur/coördinerend onderzoeker: S.A. van den Berg, arts-onderzoeker AMC (020 566 4591) Hoofdonderzoekers: Dr. H.B. van
SOP: Lokale werkwijze MR ASAP SOP: L01 Versie Nr.: 1.1 Geldig m.i.v.: 17-09-2018 Auteur/coördinerend onderzoeker: S.A. van den Berg, arts-onderzoeker AMC (020 566 4591) Hoofdonderzoekers: Dr. H.B. van
HOVON 131 CASSIOPEIA Arm B DARATUMUMAB MAINTENANCE
 In studieverband :.. Buiten studieverband Patiëntsticker: HOVON 3 CASSIOPEIA Arm B DARATUMUMAB MAINTENANCE Therapielijst\ aftekenlijst\aanvraag cytostatica Datum aanvraag Afdeling 2-NAT: 0945 Lengte (cm)
In studieverband :.. Buiten studieverband Patiëntsticker: HOVON 3 CASSIOPEIA Arm B DARATUMUMAB MAINTENANCE Therapielijst\ aftekenlijst\aanvraag cytostatica Datum aanvraag Afdeling 2-NAT: 0945 Lengte (cm)
Informatie brief voor patiënten die geopereerd zijn voor vroeg stadium baarmoeder kanker
 Informatie brief voor patiënten die geopereerd zijn voor vroeg stadium baarmoeder kanker Titel van het onderzoek Nazorg bij patiënten met baarmoeder kanker [ENdometrial cancer SURvivors follow-up care
Informatie brief voor patiënten die geopereerd zijn voor vroeg stadium baarmoeder kanker Titel van het onderzoek Nazorg bij patiënten met baarmoeder kanker [ENdometrial cancer SURvivors follow-up care
1 MONTELUKAST p.o. 10 mg 1 DEXAMETHASON iv 20 mg bolus 1 PARACETAMOL p.o mg. 1 CLEMASTINE iv 2 mg bolus
 In studieverband :.. Buiten studieverband:.. MDS00 ARM B: Kuur Therapielijst\ aftekenlijst\aanvraag cytostatica Patiëntsticker: Datum aanvraag Afdeling -NAT: 04 Gefaxt naar apotheek Ja/Nee Lengte (cm)
In studieverband :.. Buiten studieverband:.. MDS00 ARM B: Kuur Therapielijst\ aftekenlijst\aanvraag cytostatica Patiëntsticker: Datum aanvraag Afdeling -NAT: 04 Gefaxt naar apotheek Ja/Nee Lengte (cm)
Informatiebrief voor de vertegenwoordiger
 Informatiebrief voor de vertegenwoordiger Preventive Antibiotics in Stroke Study (PASS) Informatiebrief over de studie naar preventief gebruik van antibiotica bij patiënten met een herseninfarct of hersenbloeding.
Informatiebrief voor de vertegenwoordiger Preventive Antibiotics in Stroke Study (PASS) Informatiebrief over de studie naar preventief gebruik van antibiotica bij patiënten met een herseninfarct of hersenbloeding.
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding. De ULTRA-studie
 Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Onderzoek naar de beste behandeling van patiënten met galstenen
 Onderzoek naar de beste behandeling van patiënten met galstenen Geachte heer/mevrouw, Wij doen onderzoek naar de beste behandeling van galstenen. Een onderzoeker zal contact met u opnemen om te vragen
Onderzoek naar de beste behandeling van patiënten met galstenen Geachte heer/mevrouw, Wij doen onderzoek naar de beste behandeling van galstenen. Een onderzoeker zal contact met u opnemen om te vragen
Inclusie criteria Ja Nee. 3. Is de patiënt in staat om naar de polikliniek te komen voor de follow-up? O O
 In- en exclusie criteria Visite datum: _2_ _0_ In- en exclusie criteria Inclusie criteria Ja Nee 1. eapr voor primair rectumcarcinoom gepland 2. Preoperatieve radiotherapie gepland of reeds ondergaan 3.
In- en exclusie criteria Visite datum: _2_ _0_ In- en exclusie criteria Inclusie criteria Ja Nee 1. eapr voor primair rectumcarcinoom gepland 2. Preoperatieve radiotherapie gepland of reeds ondergaan 3.
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Beknopt protocol Gericht aan deelnemend neurologen (principal investigators)
 Beknopt protocol Gericht aan deelnemend neurologen (principal investigators) Second IVIg Dose in Guillain-Barré Syndrome patients with poor prognosis (SID-GBS trial) Erasmus MC Johns Hopkins Hospital,
Beknopt protocol Gericht aan deelnemend neurologen (principal investigators) Second IVIg Dose in Guillain-Barré Syndrome patients with poor prognosis (SID-GBS trial) Erasmus MC Johns Hopkins Hospital,
FOD Volksgezondheid, Veiligheid van de Voedselketen en Leefmilieu. Directoraat-generaal Geneesmiddelen
 Afdeling Wig ilantie' Amazone Afdeling `138(D'(Onderzoek&Ontwikkeling) Bischoffsheimlaan 33 B-1000 BRUSSEL Belgisch Centrum voor Geneesmiddelenbewaking voor geneeesmiddelen voor humaan gebruik Uw brief
Afdeling Wig ilantie' Amazone Afdeling `138(D'(Onderzoek&Ontwikkeling) Bischoffsheimlaan 33 B-1000 BRUSSEL Belgisch Centrum voor Geneesmiddelenbewaking voor geneeesmiddelen voor humaan gebruik Uw brief
Nederlandse samenvatting
 198 Het eerste deel van dit proefschrift beschrijft de effectiviteit van clopidogrel en tirofiban in patiënten met een acuut hart infarct verwezen voor een spoed dotter behandeling. In hoofdstuk 1 werd
198 Het eerste deel van dit proefschrift beschrijft de effectiviteit van clopidogrel en tirofiban in patiënten met een acuut hart infarct verwezen voor een spoed dotter behandeling. In hoofdstuk 1 werd
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding. De ULTRA-studie
 Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
Informatiebrief over de studie naar het zeer vroeg toedienen van tranexaminezuur na een subarachnoïdale bloeding Ultra-early tranexamic acid after subarachnoid hemorrhage De ULTRA-studie Geachte mevrouw
CASE REPORT FORM. (1) Bronovo (2) MCH (3) Haga Ziekenhuis (4) LUMC (5) Maasstad zks (6) Lucas Andreas (7) St. Antonius Nieuwegein.
 CASE REPORT FORM Patientgegevens Ziekenhuis (1) Bronovo (2) MCH (3) Haga Ziekenhuis (4) LUMC (5) Maasstad zks (6) Lucas Andreas (7) St. Antonius Nieuwegein Studienummer patient Patientidentificatie in
CASE REPORT FORM Patientgegevens Ziekenhuis (1) Bronovo (2) MCH (3) Haga Ziekenhuis (4) LUMC (5) Maasstad zks (6) Lucas Andreas (7) St. Antonius Nieuwegein Studienummer patient Patientidentificatie in
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Patiëntinformatie ENSURE
 Patiëntinformatie ENSURE Informatie brief voor patiënten die geopereerd zijn voor vroeg stadium baarmoeder kanker Titel van het onderzoek Nazorg bij patiënten met baarmoeder kanker [ENdometrial cancer
Patiëntinformatie ENSURE Informatie brief voor patiënten die geopereerd zijn voor vroeg stadium baarmoeder kanker Titel van het onderzoek Nazorg bij patiënten met baarmoeder kanker [ENdometrial cancer
Vigilantie bij Omniplasma. Jo Wiersum-Osselton namens TRIP
 Vigilantie bij Omniplasma Jo Wiersum-Osselton namens TRIP TRIP Board (Medical Societies) Advisory board (Hospital associations, Sanquin BB) Hospitals blood Tf comm. Hospital laboratory clinicians national
Vigilantie bij Omniplasma Jo Wiersum-Osselton namens TRIP TRIP Board (Medical Societies) Advisory board (Hospital associations, Sanquin BB) Hospitals blood Tf comm. Hospital laboratory clinicians national
Farmacotherapeutisch bijblijven: Algemeen literatuuroverzicht en recente literatuur 18/05/2016 Sylvie Rottey
 Farmacotherapeutisch bijblijven: Algemeen literatuuroverzicht en recente literatuur 18/05/2016 Sylvie Rottey 1. Safer Prescribing A Trial of Education, Informatics, and Financial Incentives - Context:
Farmacotherapeutisch bijblijven: Algemeen literatuuroverzicht en recente literatuur 18/05/2016 Sylvie Rottey 1. Safer Prescribing A Trial of Education, Informatics, and Financial Incentives - Context:
Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte (ZIP studie)
 INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
AnneClaire GNM Zaman, MSc. Coronel Instituut voor Arbeid en Gezondheid, AMC - 3 oktober 2017 Amsterdam Public Health research institute
 AnneClaire GNM Zaman, MSc Dr. Kristien MAJ Tytgat Dr. Angela GEM de Boer Prof. dr. Jean HG Klinkenbijl Prof. dr. Monique HW Frings-Dresen voor Arbeid en Gezondheid, AMC - 3 oktober 2017 Amsterdam Public
AnneClaire GNM Zaman, MSc Dr. Kristien MAJ Tytgat Dr. Angela GEM de Boer Prof. dr. Jean HG Klinkenbijl Prof. dr. Monique HW Frings-Dresen voor Arbeid en Gezondheid, AMC - 3 oktober 2017 Amsterdam Public
1 DEXAMETHASON iv 20 mg bolus 1 PARACETAMOL p.o mg. 1 CLEMASTINE iv 2 mg bolus. 01: a. RR, pols, temp b. 200 b. c.
 In studieverband :.. Buiten studieverband:.. MDS00 ARM B: Kuur Therapielijst\ aftekenlijst\aanvraag cytostatica Patiëntsticker: Datum aanvraag Afdeling -NAT: 04 Gefaxt naar apotheek Ja/Nee Lengte (cm)
In studieverband :.. Buiten studieverband:.. MDS00 ARM B: Kuur Therapielijst\ aftekenlijst\aanvraag cytostatica Patiëntsticker: Datum aanvraag Afdeling -NAT: 04 Gefaxt naar apotheek Ja/Nee Lengte (cm)
Aanvraagformulier REGISTRATIE centraal oncologie datamanager
 Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Ultra-early tranexamic acid after subarachnoid hemorrhage. E-LEARNING Versie 2 September 2017
 Ultra-early tranexamic acid after subarachnoid hemorrhage E-LEARNING Versie 2 September 2017 Inhoud Good Clinical Practice (GCP)/Wet medisch wetenschappelijk onderzoek met mensen (WMO) Introductie ULTRA
Ultra-early tranexamic acid after subarachnoid hemorrhage E-LEARNING Versie 2 September 2017 Inhoud Good Clinical Practice (GCP)/Wet medisch wetenschappelijk onderzoek met mensen (WMO) Introductie ULTRA
Klinische studies. Veel meer dan een extra tube
 Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Informatiebrief voor de patiënt in tweede instantie
 Informatiebrief voor de patiënt in tweede instantie Geachte mevrouw / mijnheer, Op het moment dat u deze brief leest bent u aan het herstellen van een beroerte (herseninfarct of hersenbloeding). Vanuit
Informatiebrief voor de patiënt in tweede instantie Geachte mevrouw / mijnheer, Op het moment dat u deze brief leest bent u aan het herstellen van een beroerte (herseninfarct of hersenbloeding). Vanuit
Informatiebrief voor de patiënt
 Informatiebrief voor de patiënt Geachte mevrouw / mijnheer, U bent getroffen door een beroerte (herseninfarct of hersenbloeding). Vanuit het Academisch Medisch Centrum (AMC) in Amsterdam wordt onderzoek
Informatiebrief voor de patiënt Geachte mevrouw / mijnheer, U bent getroffen door een beroerte (herseninfarct of hersenbloeding). Vanuit het Academisch Medisch Centrum (AMC) in Amsterdam wordt onderzoek
POLYP: een onderzoek naar de behandeling van galblaaspoliepen
 POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA?
 HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA? Instructies over de MR PROPER website en Open Clinica. Inclusie van een patiënt: Stap 1: bezoek in uw webbrowser (Internet Explorer, Google Chrome, Mozilla
HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA? Instructies over de MR PROPER website en Open Clinica. Inclusie van een patiënt: Stap 1: bezoek in uw webbrowser (Internet Explorer, Google Chrome, Mozilla
POLYP: een onderzoek naar de behandeling van galblaaspoliepen
 POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
Aanvraagformulier REGISTRATIE CENTRAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
INFORMATIE OVER EEG versie 1.2
 INFORMATIE OVER EEG versie 1.2 Algemeen De informatieoverdracht in het centrale zenuwstelsel vindt onder andere plaats door middel van elektrische activiteit van de zenuwcellen. Deze zeer geringe continue
INFORMATIE OVER EEG versie 1.2 Algemeen De informatieoverdracht in het centrale zenuwstelsel vindt onder andere plaats door middel van elektrische activiteit van de zenuwcellen. Deze zeer geringe continue
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
INFORMATIE OVER NIRS versie 1.2
 INFORMATIE OVER NIRS versie 1.2 Algemeen Bij informatieoverdracht in de hersenen wordt extra zuurstofrijk bloed aangevoerd in die hersengebieden die actief zijn bij een specifieke taak. De zuurstofrijkheid
INFORMATIE OVER NIRS versie 1.2 Algemeen Bij informatieoverdracht in de hersenen wordt extra zuurstofrijk bloed aangevoerd in die hersengebieden die actief zijn bij een specifieke taak. De zuurstofrijkheid
POLYP: een onderzoek naar de behandeling van galblaaspoliepen
 POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
POLYP: een onderzoek naar de behandeling van galblaaspoliepen Geachte heer/mevrouw, Versie 2, 05-04-2018 Bij u is vastgesteld dat u een poliep heeft in de galblaas. In Nederland wordt landelijk onderzoek
Hoe garanderen België en Europa veilige vaccins? Pieter Neels, FAGG
 Hoe garanderen België en Europa veilige vaccins? Pieter Neels, FAGG Disclaimer Niettegenstaande mijn betrokkenheid bij het Comité voor geneesmiddelen voor menselijk gebruik (CHMP), kan deze presentatie
Hoe garanderen België en Europa veilige vaccins? Pieter Neels, FAGG Disclaimer Niettegenstaande mijn betrokkenheid bij het Comité voor geneesmiddelen voor menselijk gebruik (CHMP), kan deze presentatie
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
4. Maand (België) Patiënt getransplanteerd Anders 1b. Indien Intrekken toestemming, datum
 Page 1 of 17 4. Maand 6-12-18-24 (België) H. Visit 1. Betreft visit Screening Week 1-4 Maand 3 Maand 6 Maand 9 Maand 12 Maand 15 Maand 18 Maand 21 Maand 24 2. Datum visit / / I. Patiënt informatie 1. Initialen
Page 1 of 17 4. Maand 6-12-18-24 (België) H. Visit 1. Betreft visit Screening Week 1-4 Maand 3 Maand 6 Maand 9 Maand 12 Maand 15 Maand 18 Maand 21 Maand 24 2. Datum visit / / I. Patiënt informatie 1. Initialen
INFORMATIE OVER tcs versie 1.2
 INFORMATIE OVER tcs versie 1.2 Algemeen Transcraniële zwakke stroom stimulatie (in het Engels: transcranial current stimulation, tcs) is een techniek die het mogelijk maakt om de hersenen van buitenaf
INFORMATIE OVER tcs versie 1.2 Algemeen Transcraniële zwakke stroom stimulatie (in het Engels: transcranial current stimulation, tcs) is een techniek die het mogelijk maakt om de hersenen van buitenaf
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Geachte MR CLEAN-Registry onderzoeker,
 Geachte MR CLEAN-Registry onderzoeker, Dank u zeer voor het aanmelden van een patiënt voor de MRCLEAN-Registry. Mocht u vragen hebben of onduidelijkheden kunt u onder kantooruren bellen met de MRCLEAN-Registry
Geachte MR CLEAN-Registry onderzoeker, Dank u zeer voor het aanmelden van een patiënt voor de MRCLEAN-Registry. Mocht u vragen hebben of onduidelijkheden kunt u onder kantooruren bellen met de MRCLEAN-Registry
Includeer hem maar in de studie. De familie is onderweg!
 Includeer hem maar in de studie. De familie is onderweg! Ethiek van toestemming voor onderzoek in spoedeisende situaties dr Erwin J.O. Kompanje Department of Intensive Care Spoedeisend onderzoek op intensive
Includeer hem maar in de studie. De familie is onderweg! Ethiek van toestemming voor onderzoek in spoedeisende situaties dr Erwin J.O. Kompanje Department of Intensive Care Spoedeisend onderzoek op intensive
Factsheet Indicatoren Gynaecologische Oncologie (DGOA) Start registratie: 2014
 Factsheet en Gynaecologische Oncologie (DGOA) 2017 Start registratie: 2014 Inclusie & exclusie criteria DGOA Inclusie Exclusie Alle maligne tumoren van vulva, cervix, corpus uteri en ovarium. Er zijn bewust
Factsheet en Gynaecologische Oncologie (DGOA) 2017 Start registratie: 2014 Inclusie & exclusie criteria DGOA Inclusie Exclusie Alle maligne tumoren van vulva, cervix, corpus uteri en ovarium. Er zijn bewust
Benchmark van complicaties en reïnterventies van pacemaker- of ICD implantaties. Concept / 10 januari 2019 / versie
 Benchmark van complicaties en s van pacemaker- of ICD implantaties Concept / 10 januari 2019 / versie 2018.0.4 Versie: 2018.0.4 Datum: 10 januari 2019 Voor informatie neem contact op met: Nederlandse Hart
Benchmark van complicaties en s van pacemaker- of ICD implantaties Concept / 10 januari 2019 / versie 2018.0.4 Versie: 2018.0.4 Datum: 10 januari 2019 Voor informatie neem contact op met: Nederlandse Hart
De praktijk van deferred consent bij spoedeisend onderzoek
 De praktijk van deferred consent bij spoedeisend onderzoek dr Erwin J.O. Kompanje Universitair docent klinische ethiek Klinisch ethicus Intensive care geneeskunde Het effect van wel/niet gebruik van Deferred
De praktijk van deferred consent bij spoedeisend onderzoek dr Erwin J.O. Kompanje Universitair docent klinische ethiek Klinisch ethicus Intensive care geneeskunde Het effect van wel/niet gebruik van Deferred
