1. Voorafgaand aan de klinische fase van het onderzoek
|
|
|
- Karolien Cools
- 5 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische fase van het onderzoek Tijdens deze voorbereidingsfase moeten de volgende documenten worden aangemaakt en in de archieven aanwezig zijn voordat het onderzoek formeel kan beginnen. 1.1 INVESTIGATOR S BROCHURE relevante en bijgewerkte wetenschappelijke informatie betreffende het onderzoeksproduct aan de onderzoeker is verstrekt 1.2 GETEKEND PROTOCOL EN PROTOCOL- AMENDEMENTEN, INDIEN AANWEZIG, EN VOORBEELD CASE REPORT FORM (CRF) de onderzoeker en de sponsor overeenstemming hebben bereikt over het protocol, het/de amendement(en) en het Case Report Form (CRF) 1.3 INFORMATIE DIE IS GEGEVEN AAN DE PROEFPERSOON
2 INFORMED CONSENT-FORMULIER (inclusief alle van toepassing zijnde vertalingen) Om de informed consent vast te ALLE ANDERE SCHRIFTELIJKE INFORMATIE WERVINGSADVERTENTIE (indien gebruikt) de proefpersonen relevante schriftelijke informatie (inhoud en formulering) zullen krijgen om hen in staat te stellen een volledige informed consent te geven wervingsmethoden passend en niet dwingend zijn 1.4 FINANCIËLE ASPECTEN VAN HET ONDERZOEK Om de financiële overeenkomst tussen de nderzoeker/ en de sponsor van het onderzoek vast te 1.5 VERZEKERINGSVERKLARING er schadevergoeding beschikbaar is voor (de) proefpersoon/ proefpersonen in geval van letsel in verband met het onderzoek 1.6 GETEKENDE OVEREENKOMST TUSSEN BETROKKEN PARTIJEN, BIJV. Om afspraken vast te
3 onderzoeker/ en sponsor onderzoeker/ en CRO sponsor en CRO onderzoeker/ en autoriteit(en) 1.7 GEDAGTEKEND, SCHRIFTELIJK POSITIEF OORDEEL VAN DE METC OVER HET VOLGENDE: protocol en eventuele protocolamendement(en) case report forms (indien van toepassing) informed consent-formulier(en) alle andere schriftelijke informatie die aan de proefpersoon/-personen wordt verstrekt advertentie voor werving van proefpersonen (indien gebruikt) vergoeding aan proefpersonen (indien van toepassing) alle andere documenten die een positief oordeel hebben gekregen het klinisch onderzoek positief is beoordeeld door de METC. Om het versienummer en de datum van het/de document(en) vast te 1.8 SAMENSTELLING VAN DE METC de samenstelling van de METC in overeenstemming is met GCP 1.9 TOESTEMMING/GOEDKEURING/ AANMELDING VAN PROTOCOL BIJ BEVOEGDE AUTORITEITEN toestemming/goedkeuri ng door, of aanmelding bij de bevoegde autoriteit(en)
4 heeft plaatsgevonden voordat het klinisch onderzoek is begonnen, in overeenstemming met de relevante wettelijke vereisten 1.10 CURRICULUM VITAE EN/OF ANDERE RELEVANTE DOCUMENTEN OM DE KWALIFICATIES VAN DE ONDERZOEKER(S) EN SUB- ONDERZOEKER(S) AAN TE TONEN Om bevoegdheden en bekwaamheden vast te, waaruit de geschiktheid blijkt om onderzoek uit te voeren en/of medische supervisie uit te oefenen over proefpersonen 1.11 NORMAALWAARDEN/ REFERENTIE-INTERVALLEN VOOR MEDISCHE/LABORATORIUM/TECH- NISCHE PROCEDURES EN/OF BEPALINGEN ZOALS BESCHREVEN IN HET PROTOCOL Om de normaalwaarden en referentie-intervallen van de bepalingen vast te 1.12 MEDISCHE/LABORATORIUM/ TECHNISCHE PROCEDURES/ BEPALINGEN certificatie of accreditatie of vastgestelde interne kwaliteitsbeheersing en/of eterne kwaliteitsbeoordeling of andere validatie Om de geschiktheid van de faciliteiten ter uitvoering van de vereiste bepaling 1.13 VOORBEELDEN VAN ETIKETTEN VOOR DE VERPAKKING VAN HET ONDERZOEKSPRODUCT Om de naleving van relevante regels voor etikettering en de geschiktheid van de
5 instructies verstrekt aan de proefpersonen vast te 1.14 INSTRUCTIES VOOR HET HANTEREN VAN HET/DE ONDERZOEKSPRODUCT(EN) EN ONDERZOEKSMATERIALEN (indien niet in het protocol of in de IB beschreven) Om de instructies vast te die nodig zijn om te zorgen voor het adequaat opslaan, verpakken, verstrekken en gebruik van de onderzoeksproducten en ander onderzoeksmateriaal 1.15 VRACHTBRIEVEN VOOR ONDERZOEKSPRODUCT(EN) EN ONDERZOEKSMATERIAAL Om de verzenddatum, de batchnummers en wijze van verzending van (het) onderzoeksproduct(en) en onderzoeksmateriaal vast te. Hierdoor is het mogelijk om het batchnummer, de omstandigheden bij het vervoer en het beheer van deze producten te controleren 1.16 ANALYSECERTIFICATEN VAN VERZONDEN ONDERZOEKSPRODUCT(EN) Om de identiteit, zuiverheid en de sterkte van de onderzoeksgeneesmidd elen die tijdens het onderzoek gebruikt zullen worden vast te
6 1.17 PROCEDURES VOOR HET VERBREKEN VAN DE CODE BIJ GEBLINDEERDE ONDERZOEKEN Om vast te hoe, in noodgevallen, de identiteit van een geblindeerd geneesmiddel in onderzoek kan worden onthuld zonder de blindering van het onderzoek voor de overige proefpersonen te verbreken (door derden indien van toepassing) 1.18 MASTER RANDOMISATIELIJST Om de methode van randomisering van de onderzoekspopulatie vast te (door derden indien van toepassing) 1.19 RAPPORTAGE VAN MONITORBEZOEK VÓÓR AANVANG VAN HET ONDERZOEK de onderzoekslocatie geschikt is voor het klinisch onderzoek (mag gecombineerd worden met 1.20) 1.20 RAPPORTAGE VAN DE AANVANG VAN HET KLINISCH ONDERZOEK de procedures inzake het klinisch onderzoek doorgenomen zijn met de onderzoeker en met het betrokken onderzoeksteam (mag gecombineerd worden met 1.19)
7
8 2. Tijdens de klinische uitvoering van het onderzoek Behalve dat bovengenoemde documenten in de archieven aanwezig moeten zijn, moet gedurende het onderzoek het volgende aan de archieven worden toegevoegd als bewijs dat alle nieuwe relevante informatie wordt vastgelegd zodra die beschikbaar komt. 2.1 BIJGEWERKTE VERSIES VAN DE INVESTIGATOR S BROCHURE de onderzoeker tijdig van nieuwe relevante informatie op de hoogte wordt gesteld 2.2 ALLE WIJZIGINGEN VAN: protocol/amendement(en) en CRF s informed consent-formulier alle andere schriftelijke informatie die aan de proefpersonen wordt verstrekt wervingsadvertentie (indien gebruikt) Om wijzigingen tijdens het onderzoek van deze aan het onderzoek gerelateerde documenten vast te 2.3 VASTGELEGD EN VAN EEN DATUM VOORZIEN POSITIEF OORDEEL VAN DE METC OVER HET VOLGENDE: protocolamendement(en) wijziging(en) in informed consentformulier alle andere schriftelijke informatie die aan de proefpersoon wordt verstrekt wervingsadvertentie (indien gebruikt) alle andere documenten het/de amendement(en) en/of de wijziging(en) aan de METC zijn voorgelegd en een positief oordeel hebben gekregen. Om het versienummer en de datum van het/de document(en) vast te
9 waarvoor een positief oordeel is gegeven doorlopende beoordeling van het onderzoek noodzakelijk) 2.4 AUTORISATIES/GOEDKEURINGEN/ AANMELDINGEN BIJ BEVOEGDE AUTORITEITEN WAAR VEREIST VAN: protocolamendement(en) en andere documenten de relevante regelgeving wordt nageleefd 2.5 CURRICULUM VITAE VAN NIEUWE ONDERZOEKERS EN/OF SUB-ONDERZOEKERS (zie 1.10) 2.6 BIJGEWERKTE VERSIE(S) VAN NORMAALWAARDEN/REFERENTIE- INTERVALLEN VOOR MEDISCHE/ LABORATORIUM/ TECHNISCHE PROCEDURE(S)/BEPALINGEN DIE IN HET PROTOCOL STAAN BESCHREVEN Om de normaalwaarden en de referentie-intervallen die gedurende het onderzoek worden gewijzigd vast te 2.7 NIEUWE VERSIES VAN MEDISCHE/LABORATORIUM/TECHNI SCHE PROCEDURES/BEPALINGEN certificatie of accreditatie of vastgestelde kwaliteitsbeheersing en/of eterne kwaliteitsbeoordeling of andere validatie de bepalingen gedurende de gehele onderzoeksperiode toereikend zijn 2.8 DOCUMENTATIE VAN VERZENDING VAN HET/DE ONDERZOEKS-PRODUCT(EN) EN ANDERE AAN HET ONDERZOEK GERELATEERDE MATERIALEN (zie 1.15)
10 2.9 ANALYSECERTIFICAAT/- CERTIFICATEN VOOR NIEUWE BATCHES VAN DE ONDERZOEKSPRODUCTEN (zie 1.16) 2.10 RAPPORTEN VAN MONITORBEZOEKEN Om de bezoeken van de monitor aan de onderzoekslocatie en zijn/haar bevindingen daarbij vast te 2.11 RELEVANTE CONTACTEN ANDERS DAN BEZOEKEN AAN DE ONDERZOEKSLOCATIE - brieven - vergadernotities - telefoonnotities Om alle overeenkomsten en belangrijke discussies met betrekking tot de administratie van het klinisch onderzoek, afwijkingen van het protocol, de uitvoering van het klinisch onderzoek en de rapportage van adverse events vast te 2.12 GETEKENDE INFORMED CONSENTFORMULIEREN van elke proefpersoon de toestemming is verkregen in overeenstemming met GCP en met het protocol, en wel op een datum die voorafgaat aan de deelname aan het onderzoek. Tevens om de toestemming voor directe inzage vast
11 te (zie 1.3) 2.13 BRONDOCUMENTEN de proefpersoon inderdaad bestaat en om de integriteit van de verzamelde onderzoeksgegevens te onderbouwen. Dit omvat oorspronkelijke documenten die gerelateerd zijn aan het klinisch onderzoek, de medische behandeling en de ziektegeschiedenis van de proefpersoon 2.14 INGEVULDE, GETEKENDE EN VAN EEN DATUM VOORZIENE CASE REPORT FORMS (CRF S) de onderzoeker of een daartoe gemachtigd staflid van de onderzoeker de vastgelegde waarnemingen bevestigt (kopie) (origineel) 2.15 DOCUMENTATIE VAN CORRECTIES IN HET CRF Om alle veranderingen/ toevoegingen of verbeteringen in het CRF, die zijn aangebracht nadat de oorspronkelijke gegevens waren ingevoerd, vast te (kopie) (origineel) 2.16 MELDING DOOR DE ONDERZOEKER AAN DE SPONSOR Melding van onderzoeker aan de
12 VAN SERIOUS ADVERSE EVENTS EN DE BIJBEHORENDE RAPPORTEN sponsor van serious adverse events en de bijbehorende rapporten in overeenstemming met ICH GCP artikel MELDING DOOR DE SPONSOR EN/OF ONDERZOEKER, INDIEN VAN TOEPASSING, AAN DE BEVOEGDE AUTORITEIT(EN) EN METC( S) VAN ONVERWACHTE ERNSTIGE BIJWERKINGEN EN VAN ANDERE VEILIGHEIDSINFORMATIE Melding door de sponsor en/of onderzoeker, waar van toepassing, aan de bevoegde autoriteit(en) en METC(s) van onverwachte ernstige bijwerkingen in overeenstemming met ICH GCP artikel 5.17 en en van andere veiligheidsinformatie in overeenstemming met ICH GCP artikel MELDING VAN VEILIGHEIDSINFORMATIE DOOR DE SPONSOR AAN ONDERZOEKERS Melding van veiligheidsinformatie door de sponsor aan onderzoekers in overeenstemming met ICH GCP artikel INTERIM- OF JAARLIJKSE RAPPORTEN AAN DE METC EN AUTORITEIT(EN) Tussentijdse of jaarlijkse rapporten aan de METC in overeenstemming met 4.10 en aan de autoriteit(en) in overeenstemming met ICH GCP artikel SCREENINGLIJST VAN Lijst van proefpersonen
13 PROEFPERSONEN VOOR HET KLINISCH ONDERZOEK die gescreend zijn in de fase voorafgaand aan het onderzoek 2.21 CODELIJST PROEFPERSOON- IDENTIFICATIE de onderzoeker/ beschikt over een vertrouwelijke lijst van namen van alle proefpersonen aan wie een klinisch onderzoeksnummer is toegewezen bij toelating tot het onderzoek. Stelt de onderzoeker/ in staat elke proefpersoon te identificeren 2.22 INCLUSIELIJST PROEFPERSONEN Om de chronologische inclusie van proefpersonen vast te door middel van een klinisch onderzoeksnummer 2.23 VERANTWOORDING ONDERZOEKSPRODUCTEN OP DE ONDERZOEKSLOCATIE de onderzoeksproducten zijn gebruikt in overeenstemming met het protocol 2.24 ANDTEKENINGENLIJST Om de handtekeningen en parafen vast te van alle personeelsleden die gemachtigd zijn om
14 CRF s in te vullen en/of te corrigeren 2.25 LIJST VAN BEWAARDE MONSTERS VAN LICHAAMSVLOEISTOFFEN OF WEEFSELS (indien van toepassing) Om locatie en identificatie van bewaarde monsters vast te als heranalyse nodig is
15 3. Na voltooien of stopzetten van het onderzoek Na het voltooien of stopzetten van het onderzoek moeten alle documenten die genoemd zijn onder 8.2 en 8.3 gearchiveerd zijn, samen met de volgende documenten: 3.1 VERANTWOORDING ONDERZOEKSPRODUCT OP DE ONDERZOEKSLOCATIE de onderzoeksproducten zijn gebruikt volgens het protocol. Om volledige verantwoording af te voor geneesmiddelen die op de onderzoekslocatie zijn ontvangen, aan de proefpersonen verstrekt, van de proefpersonen terugontvangen en aan de sponsor teruggezonden 3.2 DOCUMENTATIE BETREFFENDE DE VERNIETIGING VAN HET ONDERZOEKS- PRODUCT Om de vernietiging van niet-gebruikte onderzoeksproducten door de sponsor of op de onderzoekslocatie vast te (indien ter plekke vernietigd) 3.3 GECOMPLETEERDE CODELIJST PROEFPERSOON-IDENTIFICATIE Om alle proefpersonen die meegedaan hebben aan het onderzoek te kunnen identificeren, als nazorg nodig is. Deze lijst moet als vertrouwelijk worden behandeld en gedurende een
16 3.4 AUDIT-CERTIFICAAT (indien beschikbaar) 3.5 AFSLUITEND MONITOR-RAPPORT VAN HET ONDERZOEK 3.6 RANDOMISATIECODE EN DOCUMENTATIE BETREFFENDE VERBREKING VAN DE ONDERZOEKSCODES overeengekomen periode bewaard worden een audit is uitgevoerd alle vereiste activiteiten voor het afsluiten van het onderzoek zijn voltooid en dat kopieën van essentiële documenten in de juiste dossiers zijn gearchiveerd Aan sponsor geretourneerd om eventuele verbreking van codes vast te 3.7 DEFINITIEF RAPPORT VAN DE ONDERZOEKER AAN DE METC WAAR NODIG EN, INDIEN VAN TOEPASSING, AAN DE BEVOEGDE AUTORITEIT(EN) het onderzoek afgerond is 3.8 KLINISCH ONDERZOEKSRAPPORT Om de resultaten en de interpretatie van het onderzoek vast te (indien van toepassing)
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
STATEC trial praktische uitvoering Hilde Dijcker
 STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Inhoud van de Investigator s Brochure (IB)
 Inhoud van de Investigator s Brochure (IB) Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) 1. Algemene overwegingen De IB moet bevatten: 1.2 Titelpagina Deze moet de naam van de sponsor,
Inhoud van de Investigator s Brochure (IB) Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) 1. Algemene overwegingen De IB moet bevatten: 1.2 Titelpagina Deze moet de naam van de sponsor,
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
1. Beschrijving werkgebieden / thema s
 1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
HOVON 141 CLL. Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF
 Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
RICHTSNOER VOOR GOOD CLINICAL PRACTICE (CPMP/ICH/135/95)
 RICHTSNOER VOOR GOOD CLINICAL PRACTICE (CPMP/ICH/135/95) Stap 5, vastgesteld richtsnoer 1.5.96 (inclusief errata na Stap 4) ICH Harmonised Tripartite Guideline INHOUDSOPGAVE INHOUDSOPGAVE...i INLEIDING...1
RICHTSNOER VOOR GOOD CLINICAL PRACTICE (CPMP/ICH/135/95) Stap 5, vastgesteld richtsnoer 1.5.96 (inclusief errata na Stap 4) ICH Harmonised Tripartite Guideline INHOUDSOPGAVE INHOUDSOPGAVE...i INLEIDING...1
Aanvullende informatie bij het informatie- en toestemmingsformulier versie OCT2013
 Aanvullende informatie bij het informatie- en toestemmingsformulier versie 5.1 08OCT2013 Studie: Titel: Protocol C16010 Een fase 3, gerandomiseerd, dubbelblind, multicenter-onderzoek waarbij oraal MLN9708
Aanvullende informatie bij het informatie- en toestemmingsformulier versie 5.1 08OCT2013 Studie: Titel: Protocol C16010 Een fase 3, gerandomiseerd, dubbelblind, multicenter-onderzoek waarbij oraal MLN9708
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
GOOD CLINICAL PRACTICE
 INTERNATIONAAL RICHTSNOER VOOR GOOD CLINICAL PRACTICE VOOR HET ONDERZOEK MET GENEESMIDDELEN VERTALING NAAR DE NEDERLANDSE PRAKTIJK eerste versie: september 1993 herziene versie: maart 1995 compleet herziene
INTERNATIONAAL RICHTSNOER VOOR GOOD CLINICAL PRACTICE VOOR HET ONDERZOEK MET GENEESMIDDELEN VERTALING NAAR DE NEDERLANDSE PRAKTIJK eerste versie: september 1993 herziene versie: maart 1995 compleet herziene
Geneesmiddelenonderzoek en de ziekenhuisapotheek
 Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
Gedigitaliseerd onderzoek..
 Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanvraagformulier REGISTRATIE centraal oncologie datamanager
 Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Dit onderzoek wordt uitgevoerd en gefinancierd door Acerta (een farmaceutisch bedrijf).
 Titel: Een gerandomiseerd, multicenter, open-label, fase 3-onderzoek naar de nietinferioriteit van ACP-196 versus Ibrutinib bij eerder behandelde proefpersonen met hoog-risico chronische lymfatische leukemie
Titel: Een gerandomiseerd, multicenter, open-label, fase 3-onderzoek naar de nietinferioriteit van ACP-196 versus Ibrutinib bij eerder behandelde proefpersonen met hoog-risico chronische lymfatische leukemie
Vragen en antwoorden over de gegevenssectie van de model-pif
 Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
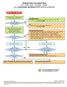 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
De rol van de verpleegkundige binnen Medischwetenschappelijk
 De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
Afdeling Sociale Zaken Gemeente Hilversum
 NALEVING VAN DE INFORMATIEPLICHT BIJ HEIMELIJKE WAARNEMING DOOR SOCIALE DIENSTEN Onderzoek door het College bescherming persoonsgegevens (CBP) naar de naleving van de informatieplicht bij heimelijke waarneming
NALEVING VAN DE INFORMATIEPLICHT BIJ HEIMELIJKE WAARNEMING DOOR SOCIALE DIENSTEN Onderzoek door het College bescherming persoonsgegevens (CBP) naar de naleving van de informatieplicht bij heimelijke waarneming
Officiële titel: Blinatumomab added to prephase and consolidation therapy in precursor B-acute lymphoblastic leukemia in adults. A phase II trial.
 HOVON 146 ALL NL61022.078.17 Informatie voor de proefpersoon behorende bij het onderzoek HOVON 146: Blinatumomab toegevoegd aan prefase en consolidatie behandeling van volwassenen met een precursor B-cel
HOVON 146 ALL NL61022.078.17 Informatie voor de proefpersoon behorende bij het onderzoek HOVON 146: Blinatumomab toegevoegd aan prefase en consolidatie behandeling van volwassenen met een precursor B-cel
INFORMATIEBLAD VOOR PROEFPERSONEN ONDERZOEK VAN TRANSTHYRETINE-GEASSOCICIEERDE AMYLOÏDOSEN (THAOS)
 INFORMATIEBLAD VOOR PROEFPERSONEN ONDERZOEK VAN TRANSTHYRETINE-GEASSOCICIEERDE AMYLOÏDOSEN (THAOS) Protocoltitel: Protocolnummer: Naam opdrachtgever: Naam van THAOS-arts, contactgegevens en telefoonnummer:
INFORMATIEBLAD VOOR PROEFPERSONEN ONDERZOEK VAN TRANSTHYRETINE-GEASSOCICIEERDE AMYLOÏDOSEN (THAOS) Protocoltitel: Protocolnummer: Naam opdrachtgever: Naam van THAOS-arts, contactgegevens en telefoonnummer:
Informatie voor patiënten en toestemmingsformulier behorende bij het onderzoek:
 Informatie voor patiënten en toestemmingsformulier behorende bij het onderzoek: Titel: Karakterisering van buffycoat afgeleide granulocyten (witte bloedcellen) om klinische parameters te identificeren
Informatie voor patiënten en toestemmingsformulier behorende bij het onderzoek: Titel: Karakterisering van buffycoat afgeleide granulocyten (witte bloedcellen) om klinische parameters te identificeren
Model informatiebrief medisch onderwijsonderzoek Met voorbeeldpassages versie juli 2017
 Model informatiebrief medisch onderwijsonderzoek Met voorbeeldpassages versie juli 2017 De brief kan voor studenten op HBO/WO niveau geschreven worden omdat de doelgroep in onderwijsonderzoek meestal studenten
Model informatiebrief medisch onderwijsonderzoek Met voorbeeldpassages versie juli 2017 De brief kan voor studenten op HBO/WO niveau geschreven worden omdat de doelgroep in onderwijsonderzoek meestal studenten
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk
 Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
5. Goedkeuring deelname door de toetsende METC 6. Start- en einddatum onderzoek 7. Rekening
 Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Lange-termijnervaringen met abatacept sc in de dagelijkse klinische praktijk
 PATIËNTENINFORMATIE EN TOESTEMMINGSFORMULIER Lange-termijnervaringen met abatacept sc in de dagelijkse klinische praktijk Geachte heer, mevrouw, U wordt uitgenodigd om deel te nemen aan een observationele
PATIËNTENINFORMATIE EN TOESTEMMINGSFORMULIER Lange-termijnervaringen met abatacept sc in de dagelijkse klinische praktijk Geachte heer, mevrouw, U wordt uitgenodigd om deel te nemen aan een observationele
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek?
 Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Informatie over dit wetenschappelijk onderzoek
 Proefpersoneninformatie / Toestemmingsverklaring voor langetermijn opslag van lichaamsmateriaal Een multi-nationaal onderzoek naar de veiligheid en effectiviteit, inclusief farmacokinetiek, van NNC-0129-0000-1003
Proefpersoneninformatie / Toestemmingsverklaring voor langetermijn opslag van lichaamsmateriaal Een multi-nationaal onderzoek naar de veiligheid en effectiviteit, inclusief farmacokinetiek, van NNC-0129-0000-1003
CCMO Structuur documenten Technische Toetsing (ass.secr.) Inhoudelijke Toetsing (secretaris)
 CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek?
 Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Vlot taalgebruik, verstaanbaar voor niet-medisch geschoolde deelnemer. Tekengrootte en spatiering voldoende groot houden.
 Algemeen ICF kort houden, focus leggen op essentiële en voor de deelnemer relevante informatie, herhalingen vermijden. Eventueel kan verwezen worden naar bijlagen voor bijkomende informatie, doch het aantal
Algemeen ICF kort houden, focus leggen op essentiële en voor de deelnemer relevante informatie, herhalingen vermijden. Eventueel kan verwezen worden naar bijlagen voor bijkomende informatie, doch het aantal
Verdiepende sessie Klinisch onderzoek MHM
 Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Het Clinical Research Bureau (CRB) van VUmc
 1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Onderzoek naar kwaliteit van antistolling bij ouderen met een lage dosering acenocoumarol, en de invloed van preciezer doseren
 Onderzoek naar kwaliteit van antistolling bij ouderen met een lage dosering acenocoumarol, en de invloed van preciezer doseren Officiële titel: More precise dosing of acenocoumarol in patients aged 80
Onderzoek naar kwaliteit van antistolling bij ouderen met een lage dosering acenocoumarol, en de invloed van preciezer doseren Officiële titel: More precise dosing of acenocoumarol in patients aged 80
INFORMATIEBRIEF VOOR PATIËNTEN Onderzoek ALS Naasten support
 INFORMATIEBRIEF VOOR PATIËNTEN Onderzoek ALS Naasten support Beste meneer, mevrouw, Wij hebben uw partner gevraagd om mee te doen aan medisch-wetenschappelijk onderzoek naar een ondersteuningsprogramma
INFORMATIEBRIEF VOOR PATIËNTEN Onderzoek ALS Naasten support Beste meneer, mevrouw, Wij hebben uw partner gevraagd om mee te doen aan medisch-wetenschappelijk onderzoek naar een ondersteuningsprogramma
Privacyverklaring Erasmus MC. Patiënten. 21 januari 2019
 21 januari 2019 Privacyverklaring Erasmus MC In het Erasmus MC werken wij samen aan het verbeteren en vernieuwen van de zorg van vandaag en de gezondheid van morgen. Dat doen we door het verlenen van zorg,
21 januari 2019 Privacyverklaring Erasmus MC In het Erasmus MC werken wij samen aan het verbeteren en vernieuwen van de zorg van vandaag en de gezondheid van morgen. Dat doen we door het verlenen van zorg,
Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte (ZIP studie)
 INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
WERKPLAN DAMWAND KOGGEHAVEN
 WERKPLAN DAMWAND KOGGEHAVEN AANLEG ROTONDE KOGGEHAVEN Projectnummer 528-15292 Projectomschrijving Aanleg rotonde Koggehaven Opdrachtgever Gemeente Vlaardingen Contract-/besteknummer OW 2010-15 BS01 Documentnummer
WERKPLAN DAMWAND KOGGEHAVEN AANLEG ROTONDE KOGGEHAVEN Projectnummer 528-15292 Projectomschrijving Aanleg rotonde Koggehaven Opdrachtgever Gemeente Vlaardingen Contract-/besteknummer OW 2010-15 BS01 Documentnummer
Revalidatie & MS Centrum vzw. V. Cuyvers Uitgavedatum: 12.05.2015 Pagina: 1 van 5
 Pagina: 1 van 5 Het ondervragen van patiënten in het kader van een eindwerk voor het bekomen van een graad van bachelor of bachelor na bachelor komt neer op een prospectieve verzameling van gegevens met
Pagina: 1 van 5 Het ondervragen van patiënten in het kader van een eindwerk voor het bekomen van een graad van bachelor of bachelor na bachelor komt neer op een prospectieve verzameling van gegevens met
Versie Privacyvoorwaarden
 Versie 2016-12 Privacyvoorwaarden A Algemeen 1. In deze privacyvoorwaarden wordt verstaan onder: a. Algemene voorwaarden: de Algemene voorwaarden van Bewerker, die onverkort van toepassing zijn op iedere
Versie 2016-12 Privacyvoorwaarden A Algemeen 1. In deze privacyvoorwaarden wordt verstaan onder: a. Algemene voorwaarden: de Algemene voorwaarden van Bewerker, die onverkort van toepassing zijn op iedere
B2BE Data Processing Overeenkomst 1. DEFINITIES
 B2BE Data Processing Overeenkomst 1. DEFINITIES "Overeenkomst" Deze Overeenkomst beschrijft de voorwaarden waarop de Klant en B2BE ermee instemmen zich aan de Algemene Verordening Gegevensbeschermings
B2BE Data Processing Overeenkomst 1. DEFINITIES "Overeenkomst" Deze Overeenkomst beschrijft de voorwaarden waarop de Klant en B2BE ermee instemmen zich aan de Algemene Verordening Gegevensbeschermings
Afdeling Werk en Inkomen Gemeente Roosendaal
 NALEVING VAN DE INFORMATIEPLICHT BIJ HEIMELIJKE WAARNEMING DOOR SOCIALE DIENSTEN Onderzoek door het College bescherming persoonsgegevens (CBP) naar de naleving van de informatieplicht bij heimelijke waarneming
NALEVING VAN DE INFORMATIEPLICHT BIJ HEIMELIJKE WAARNEMING DOOR SOCIALE DIENSTEN Onderzoek door het College bescherming persoonsgegevens (CBP) naar de naleving van de informatieplicht bij heimelijke waarneming
kennis. kunde. kwaliteit. Privacy reglement
 kennis. kunde. kwaliteit. Privacy reglement Januari 2013 Reglement opvragen patiëntengegevens Kader Dit reglement is opgesteld binnen de kaders van de Wet op de Geneeskundige Behandelings Overeenkomst
kennis. kunde. kwaliteit. Privacy reglement Januari 2013 Reglement opvragen patiëntengegevens Kader Dit reglement is opgesteld binnen de kaders van de Wet op de Geneeskundige Behandelings Overeenkomst
1 Onderwerp Wet- en regelgeving EU-Regelgeving Begrippen en definities Benodigdheden Werkwijze...
 Code K-IK-EP-W09 Versie 01 Ingangsdatum 28-08-2019 pag. 1 van 6 Versie Goedkeuring datum Wijzigingen ten opzichte van vorige versie 03 02 01 28-08-2019 Oude code was WIEP-004. Nieuw sjabloon, opnieuw begonnen
Code K-IK-EP-W09 Versie 01 Ingangsdatum 28-08-2019 pag. 1 van 6 Versie Goedkeuring datum Wijzigingen ten opzichte van vorige versie 03 02 01 28-08-2019 Oude code was WIEP-004. Nieuw sjabloon, opnieuw begonnen
Informatiebrief en Toestemmingsformulier Pre-Screening
 Informatiebrief en Toestemmingsformulier Pre-Screening Behorend bij het hoofdonderzoek: Een onderzoek naar de werking van ABT-414 ter aanvulling op de standaardbehandeling bij patiënten, waarbij onlangs
Informatiebrief en Toestemmingsformulier Pre-Screening Behorend bij het hoofdonderzoek: Een onderzoek naar de werking van ABT-414 ter aanvulling op de standaardbehandeling bij patiënten, waarbij onlangs
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
ACCOUNTANTS & ADVISEURS VERWERKERSVOORWAARDEN 1. Algemeen In deze verwerkersvoorwaarden wordt verstaan onder: 1.1 Algemene voorwaarden: de Algemene vo
 1. Algemeen In deze verwerkersvoorwaarden wordt verstaan onder: 1.1 Algemene voorwaarden: de Algemene voorwaarden van Verwerker, die onverkort van toepassing zijn op iedere afspraak tussen Verwerker en
1. Algemeen In deze verwerkersvoorwaarden wordt verstaan onder: 1.1 Algemene voorwaarden: de Algemene voorwaarden van Verwerker, die onverkort van toepassing zijn op iedere afspraak tussen Verwerker en
Klinische studies. Veel meer dan een extra tube
 Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Aanvraagformulier REGISTRATIE oncologie datamanager
 Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Privacyverklaring Stamboek Blonde d Aquitaine Nederland
 Privacyverklaring Stamboek Blonde d Aquitaine Nederland Het Stamboek Blonde d Aquitaine Nederland (SBAN) hecht veel waarde aan de bescherming van uw persoonsgegevens en het respecteren van uw privacy.
Privacyverklaring Stamboek Blonde d Aquitaine Nederland Het Stamboek Blonde d Aquitaine Nederland (SBAN) hecht veel waarde aan de bescherming van uw persoonsgegevens en het respecteren van uw privacy.
Wij, als InPrintMatter BV, hechten veel waarde aan een goed beheer van uw privacy gevoelige gegevens.
 Privacyverklaring InPrintMatter BV Wij, als InPrintMatter BV, hechten veel waarde aan een goed beheer van uw privacy gevoelige gegevens. Wij zijn verantwoordelijk voor het opstellen, uitvoeren en handhaven
Privacyverklaring InPrintMatter BV Wij, als InPrintMatter BV, hechten veel waarde aan een goed beheer van uw privacy gevoelige gegevens. Wij zijn verantwoordelijk voor het opstellen, uitvoeren en handhaven
Patiënteninformatie en informed consent: invriezen van embryo s
 Patiënteninformatie en informed consent: invriezen van embryo s Hierbij ontvangt u informatie over het invriezen van embryo s. Het invriezen van embryo s gebeurt in het kader van een fertiliteitsbehandeling
Patiënteninformatie en informed consent: invriezen van embryo s Hierbij ontvangt u informatie over het invriezen van embryo s. Het invriezen van embryo s gebeurt in het kader van een fertiliteitsbehandeling
Aanvraag Certificaat luchtvaartgeneeskundige instantie (AeMC) (klasse 1 en 2)
 Aanvraag Certificaat luchtvaartgeneeskundige instantie (AeMC) Met dit formulier kunt u een certificaat "luchtvaartgeneeskundig instantie (AeMC) " aanvragen. Onvolledig of onjuist ingevulde formulieren
Aanvraag Certificaat luchtvaartgeneeskundige instantie (AeMC) Met dit formulier kunt u een certificaat "luchtvaartgeneeskundig instantie (AeMC) " aanvragen. Onvolledig of onjuist ingevulde formulieren
Patiënteninformatieformulier imprint studie
 Patiënteninformatieformulier imprint studie (imaging of PSMA: Registratie en Inventarisatie voor Nederlandse Toepassing) Inleiding Uw arts heeft voorgesteld een aanvraag te doen voor een PSMA-PET-scan.
Patiënteninformatieformulier imprint studie (imaging of PSMA: Registratie en Inventarisatie voor Nederlandse Toepassing) Inleiding Uw arts heeft voorgesteld een aanvraag te doen voor een PSMA-PET-scan.
9.4.2005 Publicatieblad van de Europese Unie L 91/13
 9.4.2005 Publicatieblad van de Europese Unie L 91/13 RICHTLIJN 2005/28/EG VAN DE COMMISSIE van 8 april 2005 tot vaststelling van beginselen en gedetailleerde richtsnoeren inzake goede klinische praktijken
9.4.2005 Publicatieblad van de Europese Unie L 91/13 RICHTLIJN 2005/28/EG VAN DE COMMISSIE van 8 april 2005 tot vaststelling van beginselen en gedetailleerde richtsnoeren inzake goede klinische praktijken
INFORMATIE VOOR PROEFPERSONEN VOOR TOESTEMMING VOOR GEGEVENSVERZAMELING OVER DE ZWANGERSCHAP EN OVER HET KIND
 INFORMATIE VOOR PROEFPERSONEN VOOR TOESTEMMING VOOR GEGEVENSVERZAMELING OVER DE ZWANGERSCHAP EN OVER HET KIND Titel van het onderzoek: Officiële titel van het protocol: Sponsor: Onderzoek naar een nieuw
INFORMATIE VOOR PROEFPERSONEN VOOR TOESTEMMING VOOR GEGEVENSVERZAMELING OVER DE ZWANGERSCHAP EN OVER HET KIND Titel van het onderzoek: Officiële titel van het protocol: Sponsor: Onderzoek naar een nieuw
Bent u gevraagd voor medisch wetenschappelijk onderzoek?
 Bent u gevraagd voor medisch wetenschappelijk onderzoek? Inhoud Pagina Inleiding... 2 Medisch wetenschappelijk onderzoek... 3 Waarom zou u meedoen... 4 Onderzoeksfasen... 5 Medisch Ethische Commissie...
Bent u gevraagd voor medisch wetenschappelijk onderzoek? Inhoud Pagina Inleiding... 2 Medisch wetenschappelijk onderzoek... 3 Waarom zou u meedoen... 4 Onderzoeksfasen... 5 Medisch Ethische Commissie...
INCLUSIE SET PLAATS HIER DE PATIENTSTICKER VAN DE GEINCLUDEERDE PATIENT. ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 1 van 9
 INCLUSIE SET Als de patiënt geïncludeerd kan worden in de studie, voert de arts in het behandelcentrum de randomisatieprocedure uit na telefonische aanmelding van de patiënt(e) PLAATS HIER DE PATIENTSTICKER
INCLUSIE SET Als de patiënt geïncludeerd kan worden in de studie, voert de arts in het behandelcentrum de randomisatieprocedure uit na telefonische aanmelding van de patiënt(e) PLAATS HIER DE PATIENTSTICKER
Handleiding Study Management voor onderzoeker
 Handleiding Study Management voor onderzoeker Onderdeel van Research Manager Handleiding Research Manager onderdeel Study Management 21-07-2017 1 Inhoudsopgave Hoofdstuk: Pagina: 1. Gebruik Study Management
Handleiding Study Management voor onderzoeker Onderdeel van Research Manager Handleiding Research Manager onderdeel Study Management 21-07-2017 1 Inhoudsopgave Hoofdstuk: Pagina: 1. Gebruik Study Management
1. Algemeen In deze Verwerkersovereenkomst wordt verstaan onder:
 VERWERKERSOVEREENKOMST (EENZIJDIG) 1. Algemeen In deze Verwerkersovereenkomst wordt verstaan onder: 1.1 Algemene voorwaarden: de Algemene voorwaarden van Verwerker, die onverkort van toepassing zijn op
VERWERKERSOVEREENKOMST (EENZIJDIG) 1. Algemeen In deze Verwerkersovereenkomst wordt verstaan onder: 1.1 Algemene voorwaarden: de Algemene voorwaarden van Verwerker, die onverkort van toepassing zijn op
EVALUEREN VAN PROTOCOLLEN VAN GENEESMIDDELENONDERZOEK
 EVALUEREN VAN PROTOCOLLEN VAN GENEESMIDDELENONDERZOEK Toetsingscommissies vervullen in algemene en psychiatrische ziekenhuizen een belangrijke opdracht: het evalueren van de wetenschappelijke deugdelijkheid
EVALUEREN VAN PROTOCOLLEN VAN GENEESMIDDELENONDERZOEK Toetsingscommissies vervullen in algemene en psychiatrische ziekenhuizen een belangrijke opdracht: het evalueren van de wetenschappelijke deugdelijkheid
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk. De waarde van inwendige echo in alvleesklierontsteking met onbekende oorzaak
 Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek De waarde van inwendige echo in alvleesklierontsteking met onbekende oorzaak Officiële titel: De rol van endoscopische echografie
Proefpersoneninformatie voor deelname aan medisch-wetenschappelijk onderzoek De waarde van inwendige echo in alvleesklierontsteking met onbekende oorzaak Officiële titel: De rol van endoscopische echografie
Binnen onze specialistische hulp, met onze professionele begeleiding verwerkt Vitaalpunt je gegevens ten behoeve goede zorg en hulpverlening.
 Privacyverklaring Vitaalpunt Binnen onze specialistische hulp, met onze professionele begeleiding verwerkt Vitaalpunt je gegevens ten behoeve goede zorg en hulpverlening. Vitaalpunt vindt het van het uiterste
Privacyverklaring Vitaalpunt Binnen onze specialistische hulp, met onze professionele begeleiding verwerkt Vitaalpunt je gegevens ten behoeve goede zorg en hulpverlening. Vitaalpunt vindt het van het uiterste
